- O documento discute reações químicas de combustão, especificamente a tentativa frustrada de seu Raimundo aquecer água colocando uma panela sobre uma lata com álcool em chamas.
- O professor explica que a tentativa não funcionou porque faltou o comburente (oxigênio do ar) para sustentar a combustão, já que a lata tampou a entrada de ar.
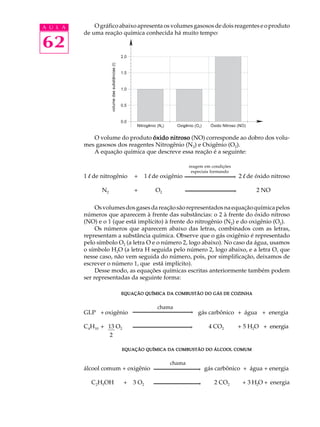
- A equação química representa os reagentes que reagem produzindo produtos e resume as reações de combustão, como a queima de GLP