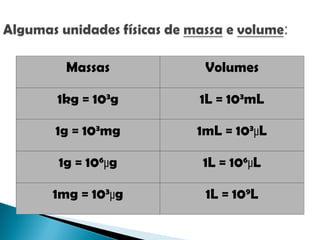
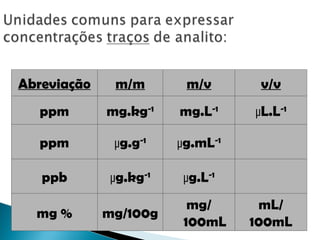
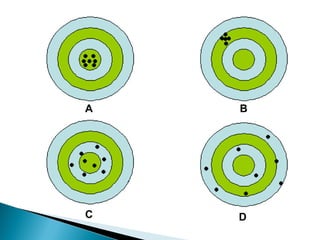
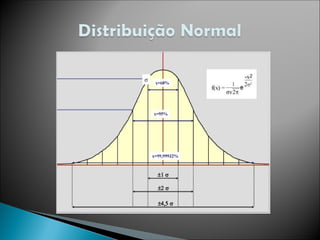
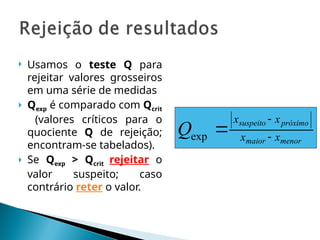
O documento aborda técnicas de identificação e quantificação de espécies químicas, incluindo análises qualitativas e quantitativas. Discute métodos clássicos e instrumentais, processos de amostragem e processamento, bem como a interpretação de dados analíticos e erros sistemáticos e indeterminados. Além disso, contém exemplos práticos de cálculos e determinações de concentração e erro em medições.