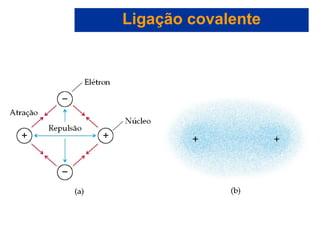
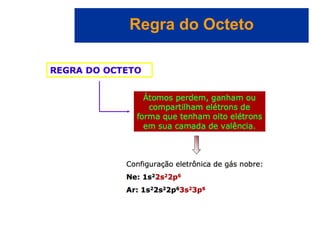
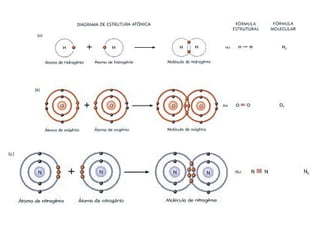
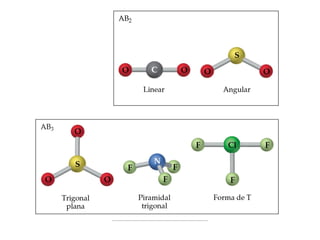
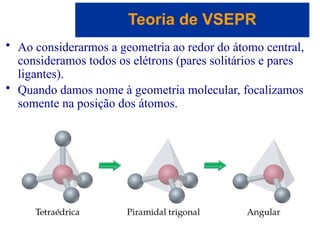
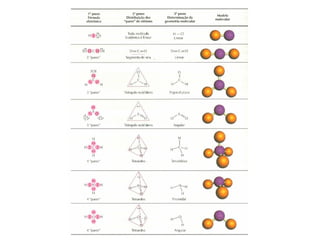
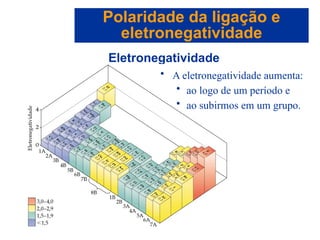
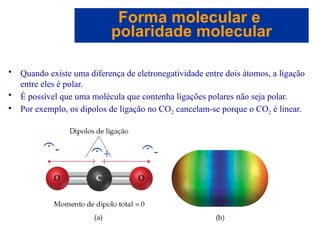
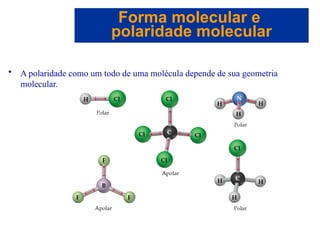
O documento explora a ligação química, abordando conceitos como ligações iônicas, covalentes e metálicas, suas propriedades e a teoria de repulsão dos pares eletrônicos da camada de valência (VSEPR) para prever a geometria molecular. Também discute polaridade de ligações e eletronegatividade, explicando como a distribuição desigual de elétrons influencia a polaridade das moléculas. Exemplos práticos e estruturas de Lewis são utilizados para ilustrar esses conceitos.