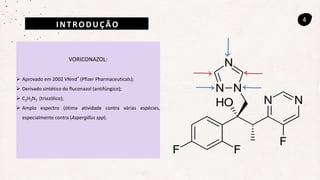
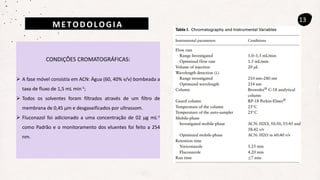
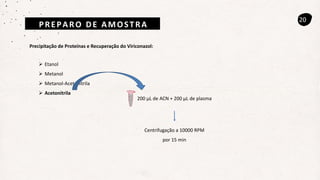
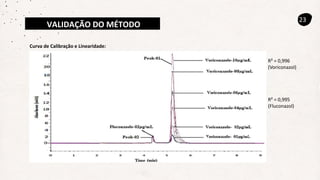
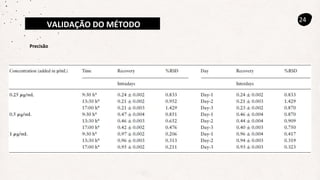
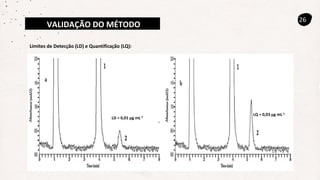
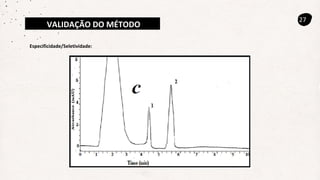
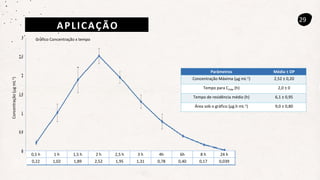
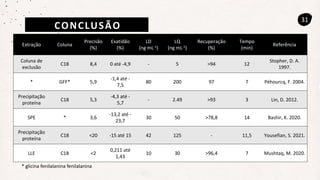
Este documento descreve um método de cromatografia líquida (CLAE) para quantificar o fármaco voriconazol em amostras de plasma sanguíneo. Ele detalha a metodologia, incluindo a otimização das condições cromatográficas, validação do método e sua aplicação na análise de amostras de participantes do estudo.




















![REFERÊNCIAS
33
BASHIR, Kamran; CHEN, Guoning; HAN, Jili; SHU, Hua; CUI, Xia; WANG, Lu; LI, Wen; FU, Qiang. Preparation of magnetic metal organic framework and development of solid phase extraction
method for simultaneous determination of fluconazole and voriconazole in rat plasma samples by HPLC. Journal Of Chromatography B, [S.L.], v. 1152, p. 122201, set. 2020. Elsevier BV.
http://dx.doi.org/10.1016/j.jchromb.2020.122201.
BORDIN, Dayanne Cristiane Mozaner; MONEDEIRO, Fernanda F. da Silva Souza; CAMPOS, Eduardo Geraldo de; ALVES, Marcela Nogueira Rabelo; BUENO, Laís Helena Picolo; MARTINIS, Bruno
Spinosa de. Técnicas de preparo de amostras biológicas com interesse forense. Scientia Chromatographica, [S.L.], v. 7, n. 2, p. 125-143, 2015. GN1 Genesis Network.
http://dx.doi.org/10.4322/sc.2015.022.
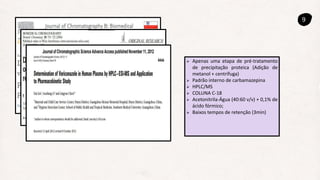
LIN, Dai; LI, Guoliang; CHEN, Lingyun. Determination of Voriconazole in Human Plasma by HPLC–ESI-MS and Application to Pharmacokinetic Study. Journal Of Chromatographic Science, [S.L.], v.
51, n. 6, p. 485-489, 11 nov. 2012. Oxford University Press (OUP). http://dx.doi.org/10.1093/chromsci/bms178.
MOREIRA, Bruna Juliana; YOKOYA, Jennifer Michiko Chauca; GAITANI, Cristiane Masetto de. Microextração líquido-líquido dispersiva (DLLME): fundamentos, inovações e aplicações biológicas.
Scientia Chromatographica, [S.L.], v. 6, n. 3, p. 186-204, 2014. GN1 Genesis Network. http://dx.doi.org/10.4322/sc.2015.005.
MUSHTAQ, Mehwish; SHAH, Yasar; SAMIULLAH, ; NASIR, Fazli; KHAN, Haroon; FAHEEM, Muhammad; NADEEM, Atif; KHAN, Sundas; KHAN, Sumaira Irum; ABBAS, Muhammad. Determination
of Voriconazole in Human Plasma Using RP-HPLC/UV-VIS Detection: method development and validation; subsequently evaluation of voriconazole pharmacokinetic profile in pakistani healthy
male volunteers. Journal Of Chromatographic Science, [S.L.], 23 set. 2021. Oxford University Press (OUP). http://dx.doi.org/10.1093/chromsci/bmab108.
PÉHOURCQ, F.; JARRY, C.; BANNWARTH, B.. Direct injection HPLC micro method for the determination of voriconazole in plasma using an internal surface reversed-phase column. Biomedical
Chromatography, [S.L.], v. 18, n. 9, p. 719-722, 2 jul. 2004. Wiley. http://dx.doi.org/10.1002/bmc.383.
QUEIROZ, Maria Eugênia Costa. Microextração em sorvente empacotado (MEPS) para a determinação de fármacos em fluidos biológicos. Scientia Chromatographica, [S.L.], v. 3, n. 3, p. 223-
229, 2011. GN1 Genesis Network. http://dx.doi.org/10.4322/sc.2011.013.](https://image.slidesharecdn.com/2022clae-220819170945-b9540b82/85/2022-CLAE-pptx-33-320.jpg)
![REFERÊNCIAS
34
STOPHER, David A.; GAGE, Richard. Determination of a new antifungal agent, voriconazole, by multidimensional high-performance liquid chromatography with direct plasma injection onto a
size-exclusion column. Journal Of Chromatography B: Biomedical Sciences and Applications, [S.L.], v. 691, n. 2, p. 441-448, abr. 1997. Elsevier BV. http://dx.doi.org/10.1016/s0378-
4347(96)00408-2.
THEURETZBACHER, Ursula; IHLE, Franziska; DERENDORF, Hartmut. Pharmacokinetic/Pharmacodynamic Profile of Voriconazole. Clinical Pharmacokinetics, [S.L.], v. 45, n. 7, p. 649-663, 2006.
Springer Science and Business Media LLC. http://dx.doi.org/10.2165/00003088-200645070-00002.
YOUSEFIAN, Sahar; DASTAN, Farzaneh; MARJANI, Majid; TABARSI, Payam; BARATI, Saghar; SHAHSAVARI, Nahid; KOBARFARD, Farzad. Determination of Voriconazole Plasma Concentration by
HPLC Technique and Evaluating Its Association with Clinical Outcome and Adverse Effects in Patients with Invasive Aspergillosis. Canadian Journal Of Infectious Diseases And Medical
Microbiology, [S.L.], v. 2021, p. 1-6, 12 abr. 2021. Hindawi Limited. http://dx.doi.org/10.1155/2021/5497427.
YU, Yong; YANG, Yu-Qing; ZENG, Nv-Jin; ZHANG, Hong-Wen; SUN, Lu-Ning; WANG, Yong-Qing. Simultaneous Determination of Voriconazole and Its Voriconazole N-Oxide Metabolite in Human
Urine by Liquid Chromatography/Tandem Mass Spectrometry. Journal Of Chromatographic Science, [S.L.], p. 1-7, 11 nov. 2021. Oxford University Press (OUP).
http://dx.doi.org/10.1093/chromsci/bmab126.](https://image.slidesharecdn.com/2022clae-220819170945-b9540b82/85/2022-CLAE-pptx-34-320.jpg)