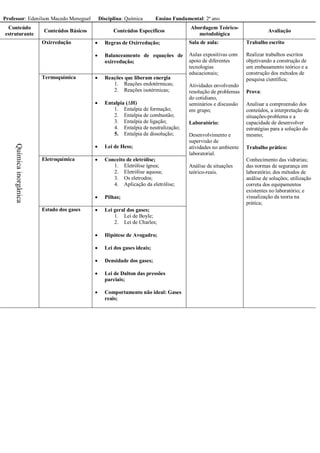
Este documento apresenta o plano de ensino de Química para o Ensino Fundamental de 1o, 2o e 3o anos. Ele descreve os conteúdos, abordagens metodológicas e métodos de avaliação para cada ano. Os conteúdos incluem química inorgânica, orgânica e físico-química. As aulas serão expositivas com apoio de tecnologias e atividades práticas. A avaliação consistirá em provas, trabalhos escritos, experimentos de laboratório e anál