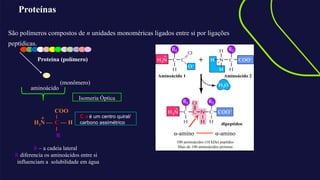
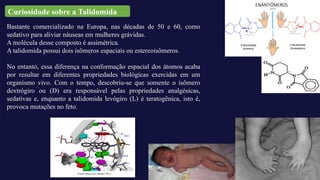
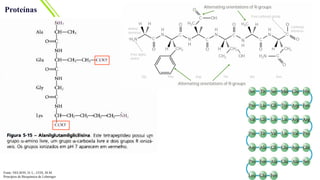
O documento aborda a bioquímica de aminoácidos e proteínas, destacando que as proteínas são polímeros formados por aminoácidos unidos por ligações peptídicas e possuem uma estrutura tridimensional essencial para sua função. A talidomida é mencionada como um exemplo de isomeria óptica, onde a configuração dos isômeros impacta as propriedades biológicas, sendo um isômero responsável por efeitos teratogênicos. Além disso, o texto discute os diferentes níveis de estrutura das proteínas e suas funções, enfatizando a importância das interações químicas na estabilidade e conformação das moléculas proteicas.