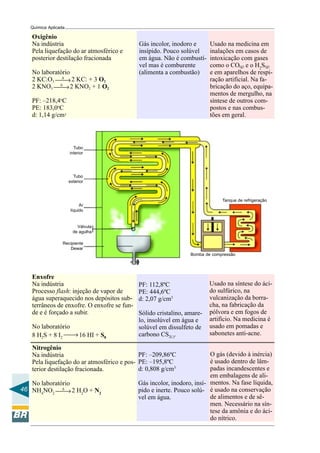
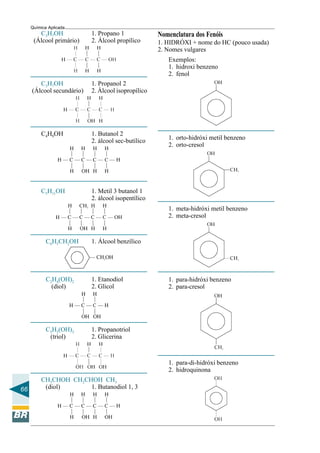
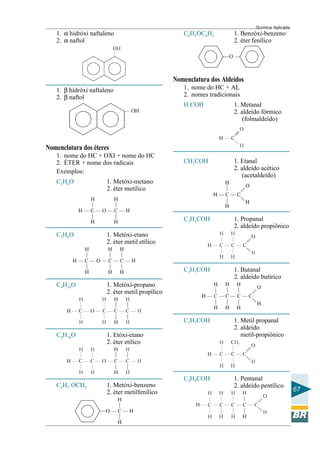
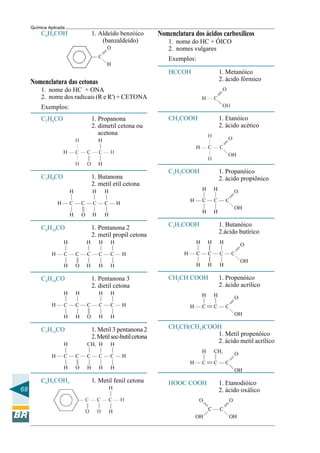
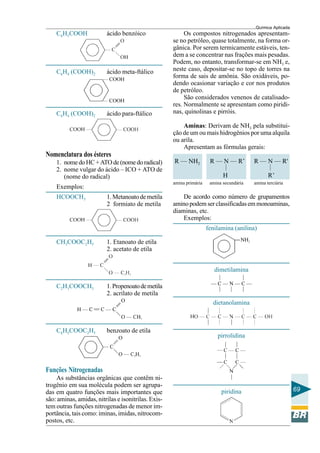
Este documento apresenta um curso de química aplicada para operadores de refinaria. Aborda tópicos de química geral e orgânica, incluindo a constituição da matéria, ligações químicas, compostos do petróleo e reações químicas relevantes para o processo de refino. O objetivo é fornecer conceitos básicos de química para melhor compreensão dos processos em uma refinaria e subsidiar a tomada de decisões durante a operação e manutenção de sistemas e equipamentos.






















![Química Aplicada
25
Eletrólitos são substâncias iônicas, que
conduzem corrente elétrica em solução e tam-
bém em estado fundido.
O sal de cozinha e outras substâncias de
caráter iônico, quando dissolvidos em água,
se subdividem em partículas carregadas ele-
tricamente, denominadas íons. No caso do sal
de cozinha (NaCl), tem-se o íon positivo Na+
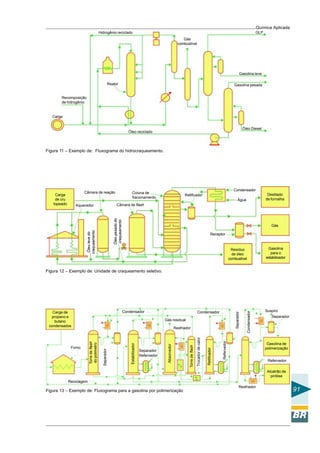
,
denominado de cátion e, o íon negativo Cl-
,
denominado de ânion. Os cátions caminham
para o pólo negativo e, ao contrário, os ânions
caminham para o pólo positivo. Desse modo,
a corrente elétrica também flui pela solução e
acende a lâmpada que está representada na
Figura 28.
Voltando à questão das funções inorgâni-
cas; as substâncias, para pertencerem à mes-
ma função, devem possuir o mesmo grupo fun-
cional. Grupo funcional significa um átomo,
um íon ou ainda um agrupamento de átomos
ou íons, responsáveis pela semelhança no com-
portamento químico das substâncias.
Como a maioria dos compostos inorgâni-
cos são iônicos ou podem formar íons, é im-
portantíssimo que as tabelas de cátions, Tabe-
la 5 e 6, e de ânions, Tabelas 7, 8 e 9, sejam
material de consulta freqüente.
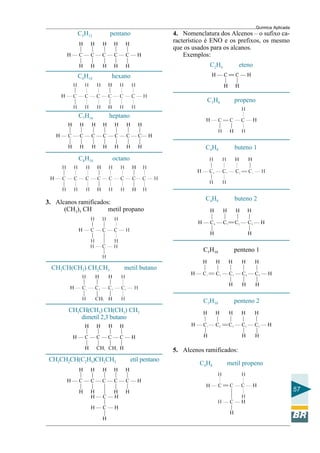
POSSUEM UMA ÚNICA VALÊNCIA
monovalentes bivalentes trivalentes tetravalentes
(1+) (2+) (3+) (4+)
H3O1+
hidrônio Be2+
berílio Al3+
alumínio
NH4
1+
amônio Mg2+
magnésio Bi3+
bismuto
Li1+
lítio Ca2+
cálcio
Na1+
sódio Sr2+
estrôncio
K1+
potássio Ba2+
bário
Rb1+
ubídio Ra2+
rádio
Cs1+
césio Zn2+
zinco
Ag1+
prata Cd2+
cádmio
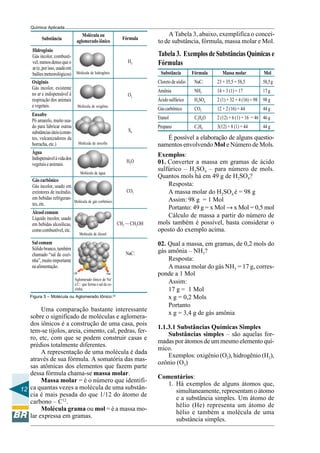
Tabela 5. Tabela de Cátions Univalentes
Tabela 6. Tabela de Cátions Polivantes
POSSUEM MAIS DE UMA VALÊNCIA
Cu1+ cuproso Cu2+ cúprico
Hg2+ mercuroso Hg2+ mercúrico
Au1+ áuros Au3+ áurico
Cr2+
cromoso Cr3+
crômico
Fe2+
ferroso Fe3+
férrico
Co2+
cobaltoso Co3+
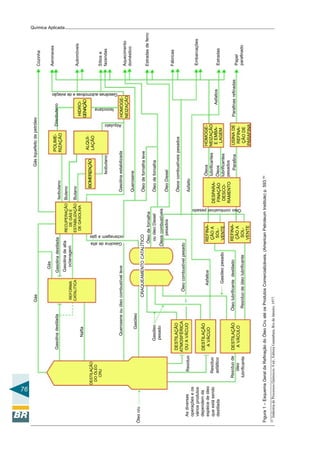
cobáltico
Ni2+
niqueloso Ni3+
niquélico
Sn2+
estanoso Sn4+
estânico
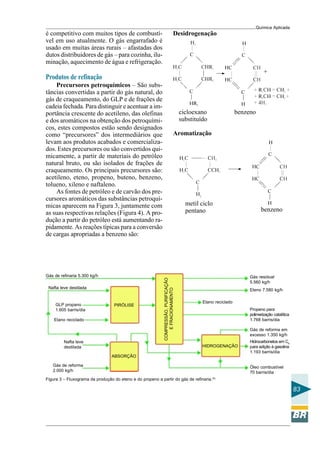
Pb2+
plumbloso Pb4+
plúmbico
Mn2+
manganoso Mn3+
manganês III Mn4+
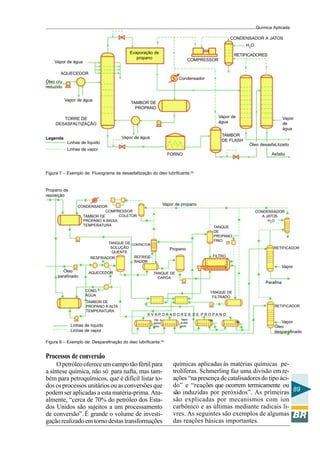
manganoso
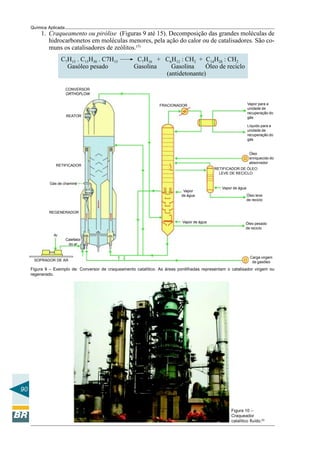
Pt2+
platinoso Pt4+
platínico
Ti4+
titanoso Ti4+
titânico
Arsênico (As) pode formar: As3+
arsenioso e As5+
arsênico
Antimônio (Sb) pode formar: Sb3+
antimonioso e Sb5+
antimônico
Doshalogênios
F1–
fluoreto
Cl1–
cloreto
ClO1–
hipoclorito
ClO1–
clorito
ClO1–
clorato
ClO1–
perclorato
Br1–
brometo
BrO1–
hipobromito
BrO1–
bromito
BrO1–
bromato
BrO1–
perbromato
I1–
iodeto
IO1–
hipoiodito
IO1–
iodito
IO1–
iodato
IO1–
periodato
Doenxofre
HS1–
bissulfeto
HSO1–
bissulfito
HSO1–
bissulfato
Donitrogênio
N1–
azoteto
NO1–
nitrito
NO1–
nitrato
NH1–
amideto
Dofósforo
PO1–
metafosfato
H2PO1–
hipofosfito
H2PO1–
dihidrogenofosfato
Docarbono
CN1–
cianeto
NC1–
isocianeto
OCN1–
cianato
NCO1–
isocianato
ONC1–
fulminato
ÂNIONS MONOVALENTES: 1–
2
3
4
SNC1–
tiocianato
HCO1–
bicarbonato
CHO1–
formiato
C2H3O1–
acetato
Dosmetaisdetransição
CrO1–
cromito
MnO1–
permanganato
FeO1–
ferrito
AuCl1–
cloroaurato
Outros
AlO1–
aluminato
AsO1–
metarsenito
SbO1–
metantimonito
BiO1–
bismutato
H1–
hidreto
OH1–
hidróxido
BO1–
metaborato
BF1–
fluorborato
2
3
4
2
3
4
3
4
2
3
2
3
2
2
4
2
4
2
2
3
2
2
4
Tabela 7. Ânions Monovalentes
Dooxigênio
O2–
óxido
O2–
peróxido
O2–
superóxido
Doenxofre
S2–
sulfeto
SO2–
sulfito
SO2–
sulfato
S2O2–
tiossulfato
S2O2–
hipossulfito
S2O2–
pirossulfito
S2O2–
hipossulfato
S2O2–
pirossulfato
S2O2–
peroxodissulfato
S4O2–
tetrationato
SnO2–
politionato
(n = 2, 3, 4, 5, 6)
ÂNIONS BIVALENTES: 2–
Donitrogênio
N2O2–
hiponitrito
Dofósforo
HPO2–
fosfito
HPO2–
monohidroge-
nofosfato
Docarbono
C2–
carbeto
CO2–
carbonato
C2O2–
oxalato
Dosmetaisdetransição
CrO2–
(orto)cromato
Cr2O2–
dicromato
MoO2–
molibidato
WO2–
tungstato
MnO2–
manganito
MnO2–
manganato
FeO2–
ferrato
PtCl2–
hexacloroplatinato
ZnO2–
zincato
Outros
BeO2–
berilato
B4O2–
tetraborato
SiO2–
metassilicato
SiF2–
fluorsilicato
SnO2–
estanito
SnO2–
estanato
PbO2–
plumbito
PbO2–
plumbato
Se2–
seleneto
SeO2–
selenito
SeO2–
selenato
Te2–
telureto
TeO2–
telurito
TeO2–
telurato
4
2
4
3
4
3
6
5
8
7
6
6
2
4
3
3
2
4
4
4
7
3
4
4
4
3
2
4
3
3
3
2
7
2
6
3
2
6
4
Tabela 8. Ânions Bivalentes
Donitrogênio
N3–
nitreto
Dofósforo
P3–
fosfeto
PO3–
(orto)fosfato
ÂNIONS TRIVALENTES: 3–
4
Dosmetaisdetransição
[Fe(CN)6]3–
ferricianeto
Outros
BO3–
(orto)borato
AsO3–
arsenito
AsO3–
(orto)arsenato
SbO3–
antimonito
SbO3–
(orto)antimonato
3
3
4
3
4
Tabela 9. Ânions Trivalentes
Dofósforo
P2O4–
hipofosfato
P2O4–
pirofosfato
ÂNIONS TETRAVALENTES: 4–
6
Docarbono
C4–
carbeto (metaneto)
Dosmetaisdetransição
[Fe(CN)6]4–
ferrocianeto
Outros
SiO4–
(orto)silicato
As2O4–
piroarsenato
Sb2O4–
piroantimonato
7
4
7
7
Tabela 10. Ânions Tetravalentes
1.6.1 Conceito de Ácidos
Segundo Arrhenius, ácidos são substâncias
que, em soluções aquosas iônicas, produzem,
como único cátion, o hidrônio – H3O+
(ver Ta-
bela 5), formado pela reação de determinados
compostos covalentes com a água.
Considere, por exemplo, a reação entre o
cloreto de hidrogênio, HCl, e a água, H2O.
3
2
3
2
4](https://image.slidesharecdn.com/quimicaaplicada-petrobras-170809102316/85/Quimica-aplicada-Petrobras-25-320.jpg)














![40
Química Aplicada
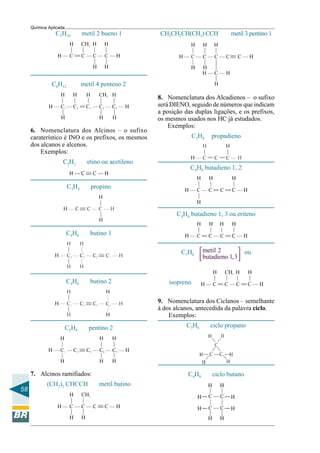
2. Qual o pH de uma solução de NaOH
0,01M? α = 100%
N=xM ∴ N = 1.0,01 ∴ N = 0,01
OH−
= N . α = 0,01 . 1 = 0,01 = 10–2
pOH = – (log 10–2
) = 2
pOH = 2, mas pH + pOH = 14 ∴
pH = 14 – pOH ∴ pH = 14 – 2
pH = 12
3. Qual o pH de uma solução contendo
3,65 g de HCl em 10 L de solução.
mol HCl = 36,5
Eqg HCl =
36,5
36,5
1
=
nº Eqg =
m 3,65
0,1
Eqg 36,5
= =
N =
nº Eqg 0,1
0,01 normal
V(1) 10
= =
2
H N . 0,01 . 1 10α+ −
= = =
( )2
pH – log 10 2
pH 2
−
= =
=
4. Calcular o pH de uma solução molar
de NH4OH cujo α = 2%
N = xM = 1 . 1 = 1 α = 0,02
OH–
= N . α = 1.0, 02 = 2.10–2
pOH = –log (2.10–2
) = –[log 2 + log 10–2
]
pOH=–(0,3–2)=2–0,3=1,7∴pH=14–1,7
pH = 12,3
5. Qual a concentração hidrogeniônica
H+
de uma solução cujo pH é 2?
pH = 2 ∴ – log H+
= 2 ∴ log H+
= –2
H+
= 10–2
6. Qual a concentração hidroxiliônica
OH−
de uma solução cujo pH é 3?
pH + pOH = 14 ∴ pOH = 14 – pH
pOH = 14 – 3 = 11 ∴
– log OH−
= 11
log OH−
= –11
OH−
= 10–11
7. A solução de um certo ácido apresenta
pH = 2. Diluimos esta solução, de modo
que seu volume torne-se 10 vezes maior.
Qual o novo pH?
Antes da diluição: pH = 2 log H 2+
∴− =
Após a diluição, a nova concentração será:
H
10
+
e o novo pH será:
pH = – log
H
10
+
= – log H+
– (–log 10) =
= 2 + 1 = 3
pH = 3
8. Um dos tampões responsáveis pela manuten-
ção do pH do sangue é o H2CO3, que tem con-
centração igual a 1,25 . 10–3
molar, e o HCO3,
queapresentaconcentração2,5.10–2
molar.O
pKa do H2CO3 é 6,1. Qual o pH do tampão?
pH = pKa + log
sal
ácido
= 6,1 + log
2
3
2,5 . 10
1,25 .10
−
−
pH = 6,1 + log 20 = 6,1 + 1,3 = 7,4
pH = 7,4
9. Considerando o tampão formado por ácido
acético 0,1 molar e acetado de sódio, 0,1
molar, qual o seu pH? Sabe-se que pKa do
ácido acético é 4,74.
pH = 4,74 + log
0,1
0,1
= 4,74 + 0 = 4,74
pH = 4,74
1.10.5 Titulação e Indicadores de Titulação
Análise Química: Processos usados
nas substâncias ou elementos que constitu-
em uma mistura ou uma substância pura.
Análise Qualitativa: Visa a determi-
nar quais as substâncias ou elementos.
Análise Quantitativa: Visa a determi-
nar quais as quantidades das substâncias ou
elementos. Os processos usados em análi-
se quantitativa são
denominados do-
sagens.
Titulação
É o nome dado
à operação feita na
prática, em labora-
tório, para determi-
nação da concentra-
ção ou molaridade
da solução de título
desconhecido.
A
C
B](https://image.slidesharecdn.com/quimicaaplicada-petrobras-170809102316/85/Quimica-aplicada-Petrobras-40-320.jpg)