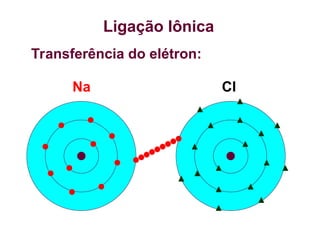
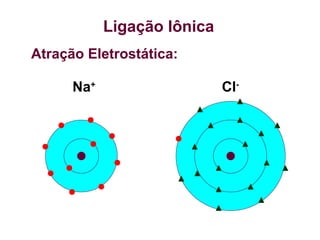
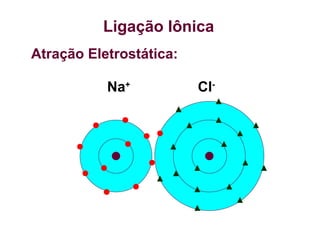
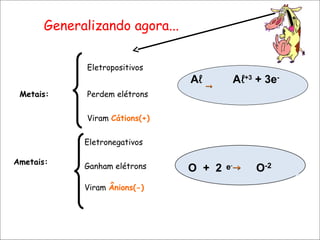
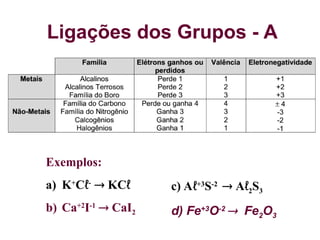
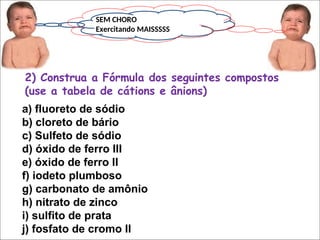
O documento aborda as ligações químicas, focando nas ligações iônicas, suas características e propriedades. Explica a formação das ligações iônicas por transferência de elétrons entre átomos, resultando em íons de cargas opostas que se atraem. Destaca a importância do conhecimento sobre essas ligações para entender fenômenos naturais e a formação de substâncias do cotidiano.