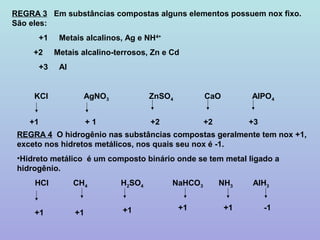
O documento apresenta 8 regras para determinar o número de oxidação de átomos em substâncias iônicas e moleculares. A regra 1 trata de elementos em substâncias simples, a regra 2 de íons monoatômicos, e as demais regras tratam de elementos em substâncias compostas, incluindo hidrogênio, oxigênio, calcogênios e halogênios. A regra 8 estabelece que a soma dos números de oxidação em uma substância ou íon deve ser igual a zero ou à carga do íon, respectivamente