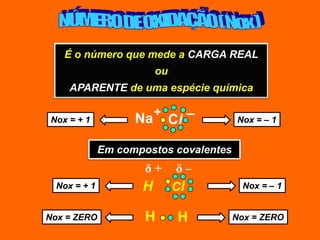
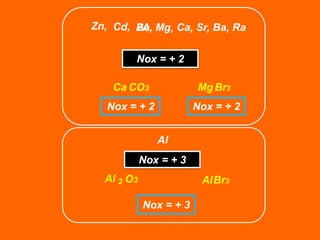
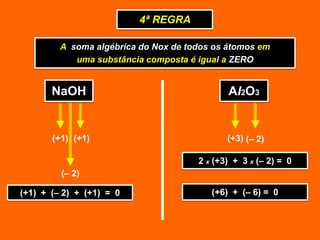
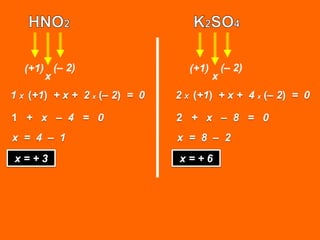
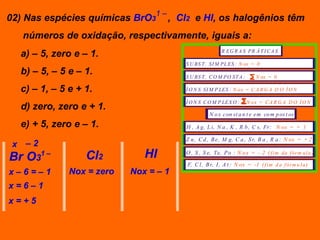
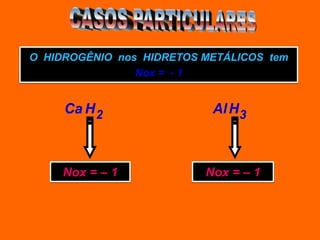
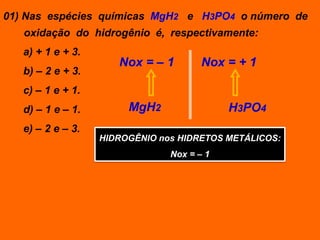
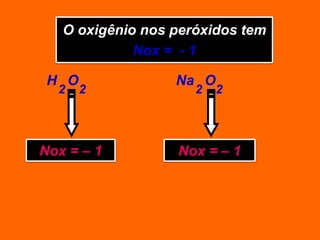
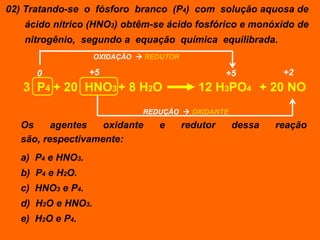
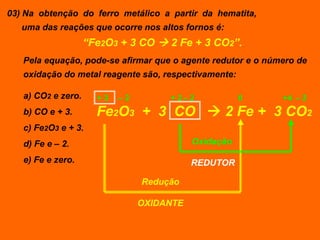
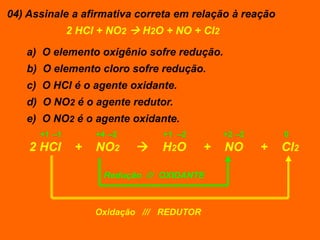
Oxidação é a perda de elétrons e redução é o ganho de elétrons. O número de oxidação (Nox) mede a carga real ou aparente de uma espécie química e é constante para alguns átomos em compostos. A soma dos Nox de todos os átomos em uma substância composta é igual a zero.