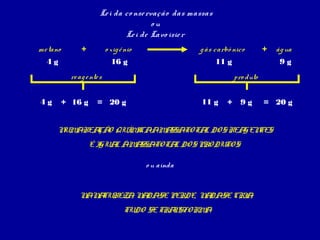
As leis das reações químicas podem ser resumidas em duas categorias principais:
1) Leis ponderais - relativas às massas das substâncias que participam das reações químicas. Incluem a lei da conservação das massas e a lei das proporções constantes.
2) Leis volumétricas - relativas aos volumes das substâncias que participam das reações químicas. De acordo com a lei de Gay-Lussac, os volumes dos gases reagentes e produtos formam uma proporção constante de números inteiros pequ