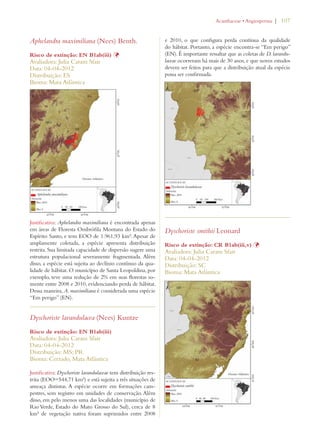
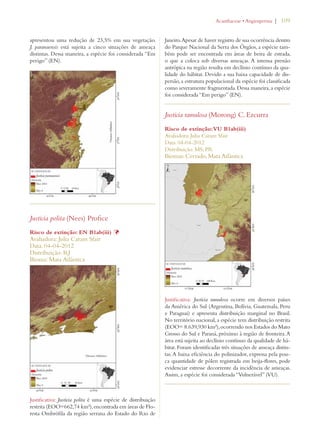
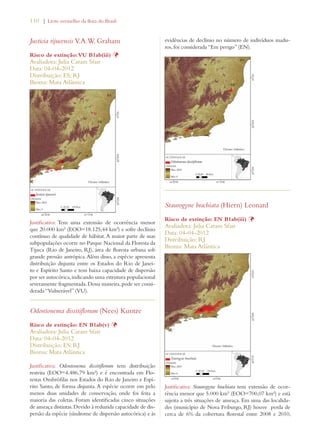
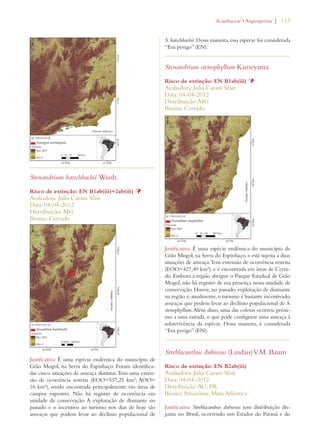
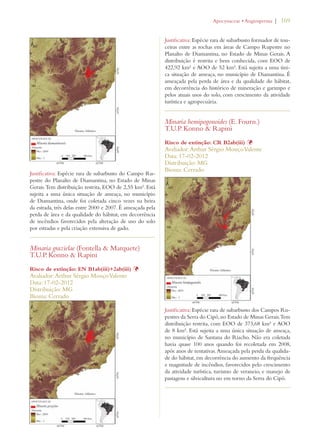
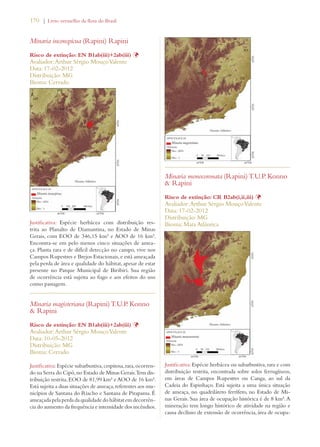
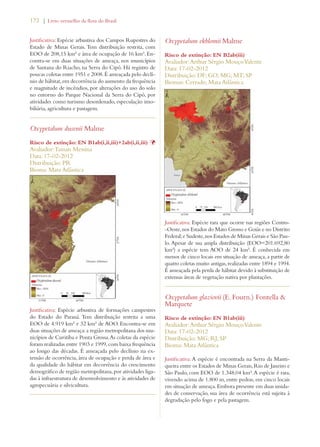
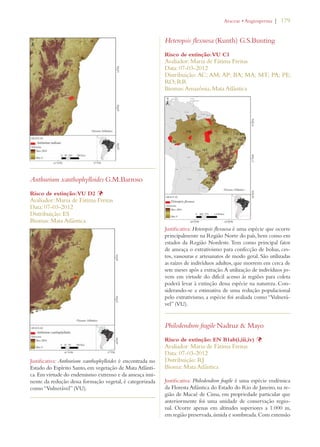
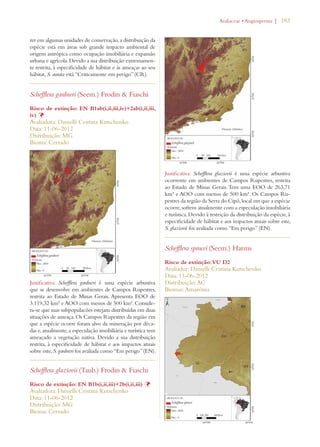
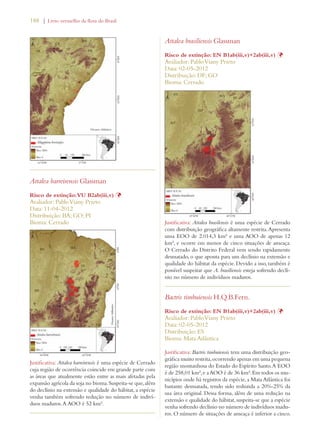
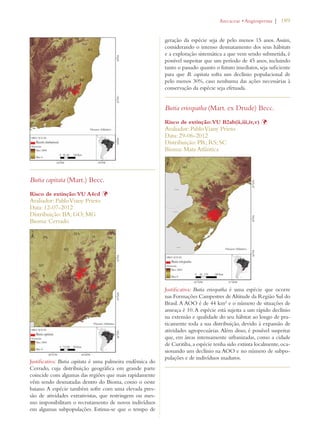
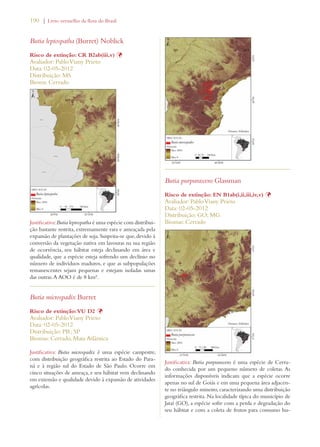
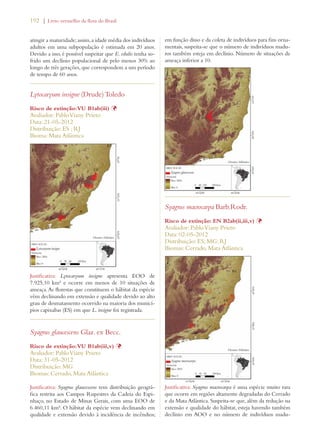
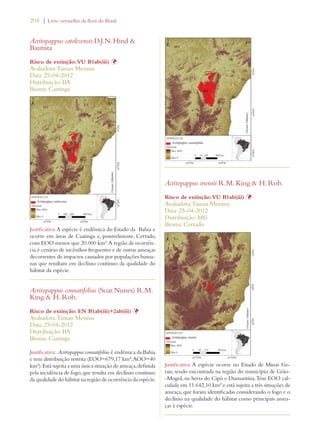
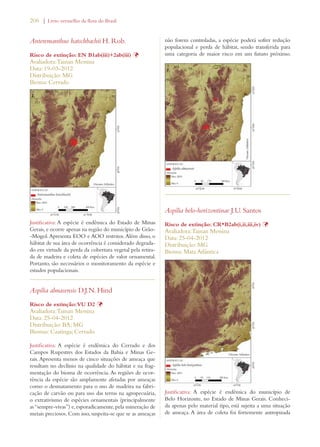
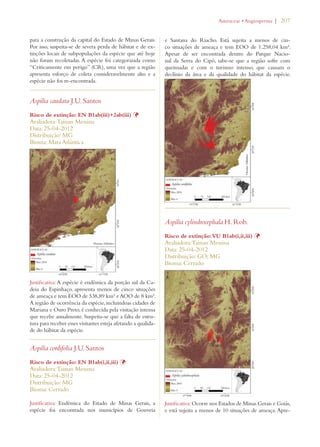
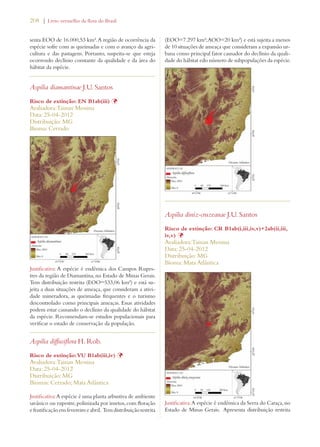
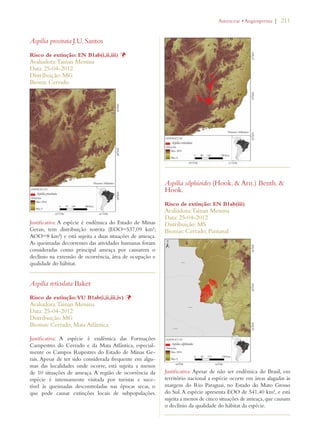
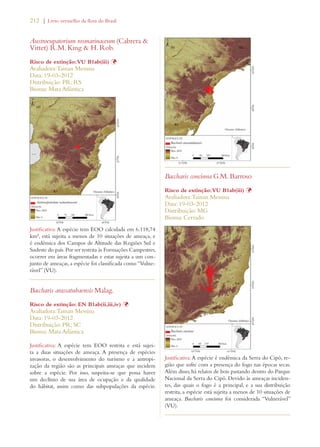
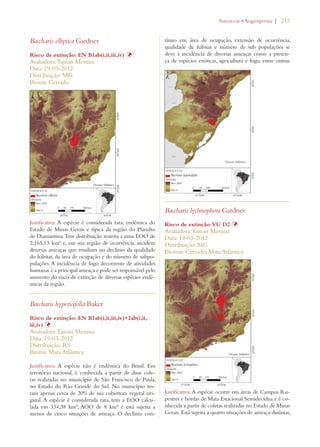
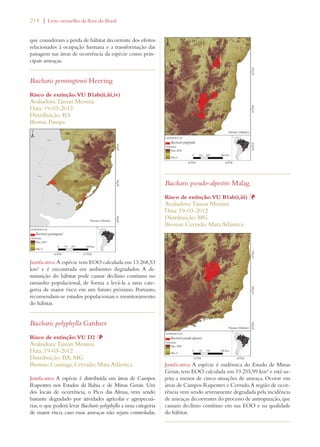
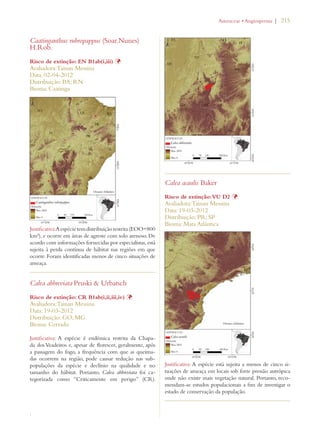
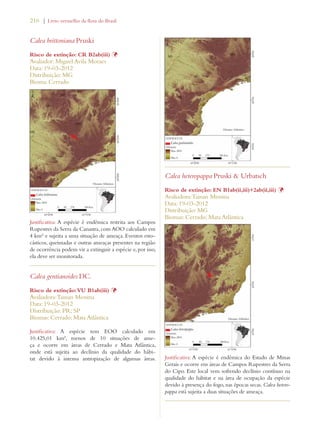
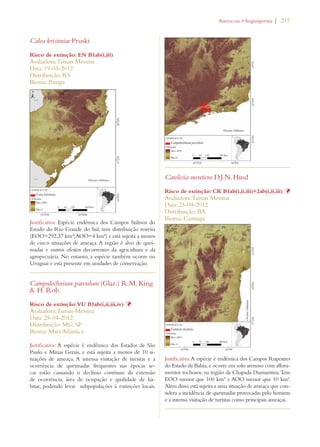
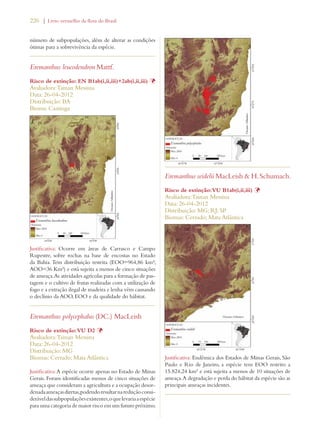
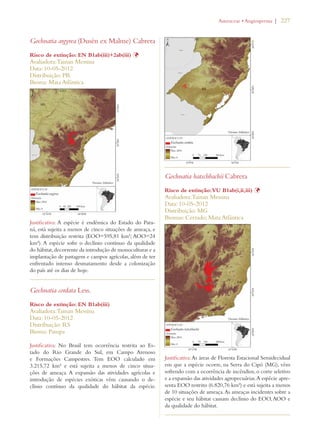
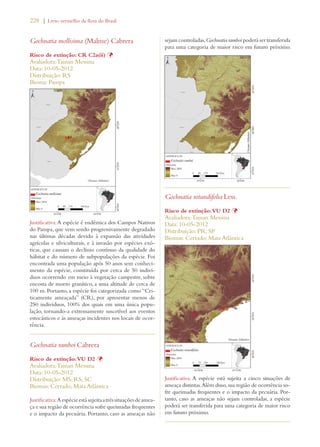
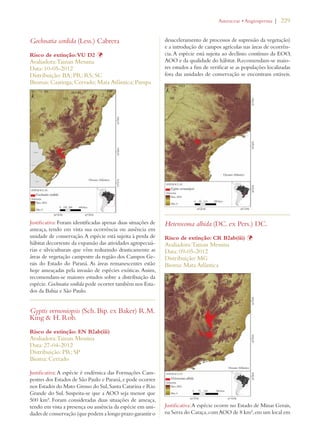
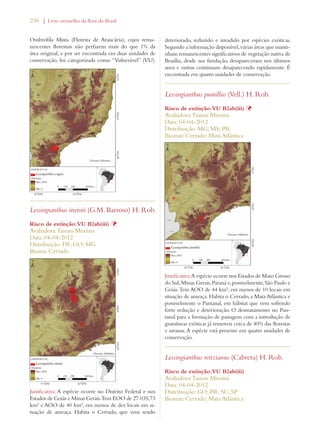
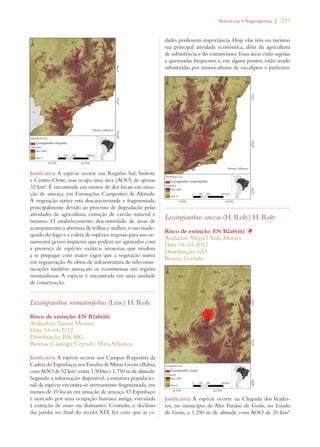
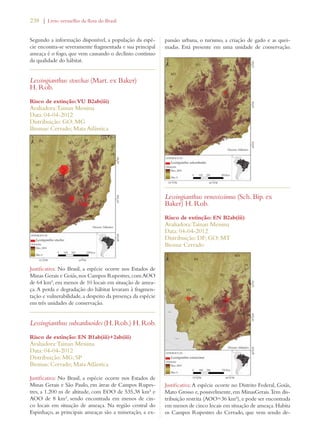
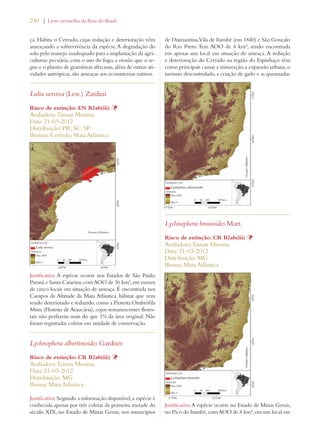
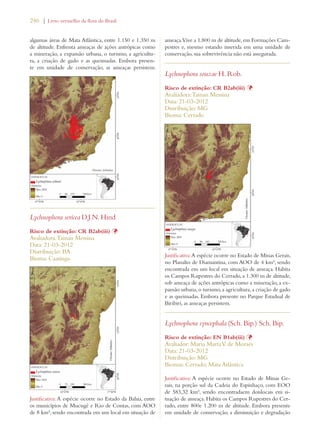
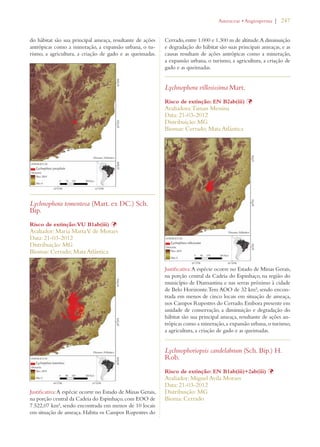
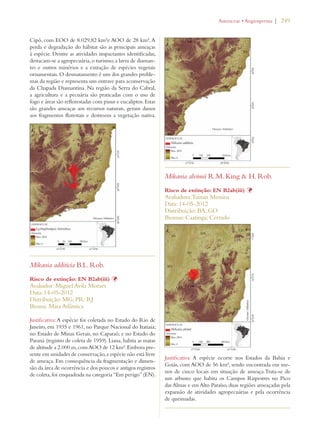
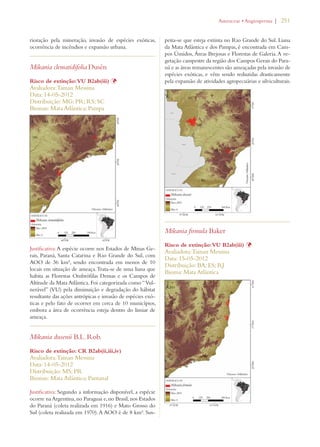
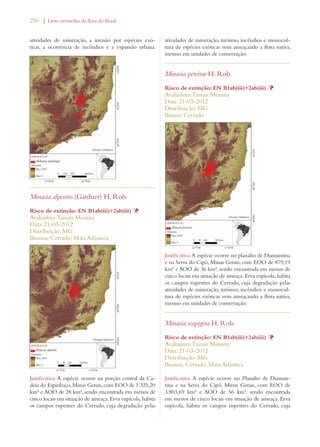
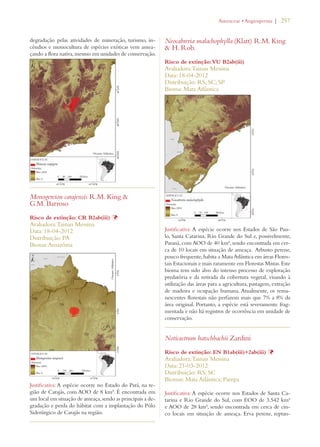
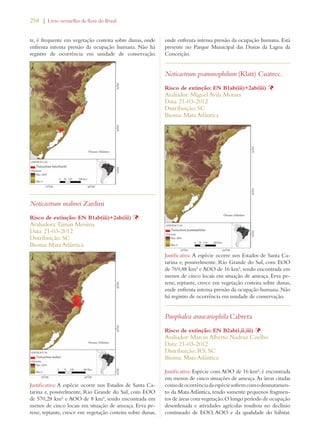
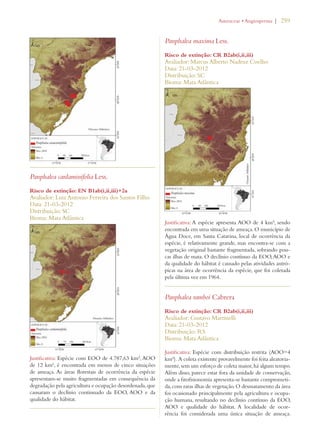
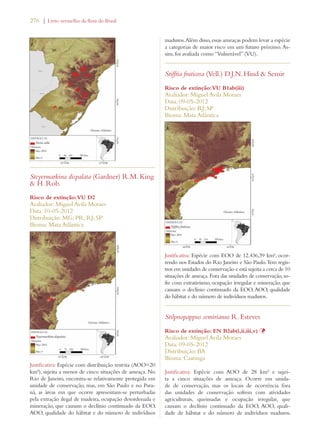
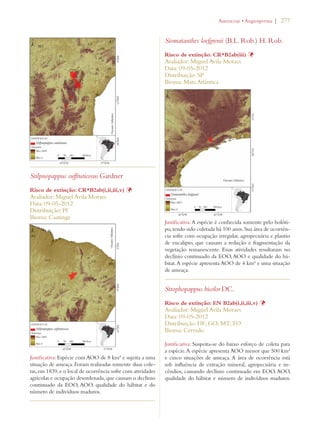
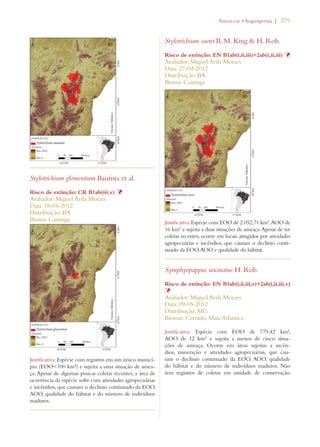
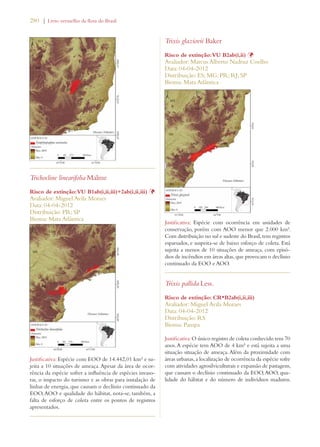
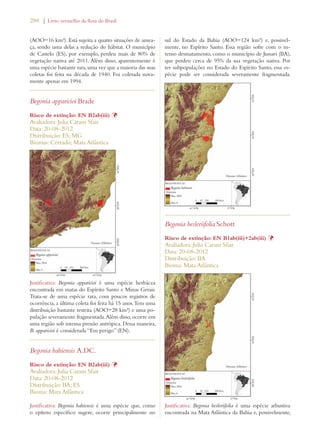
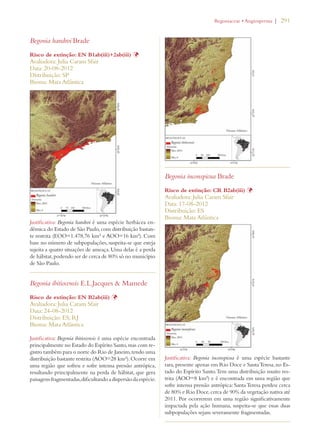
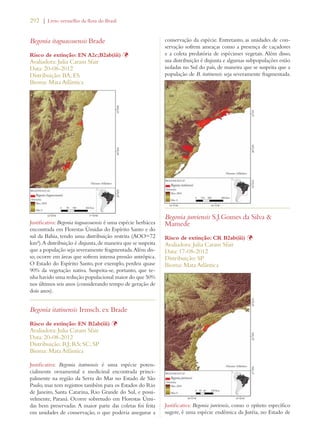
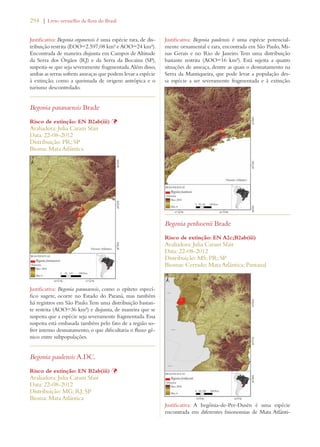
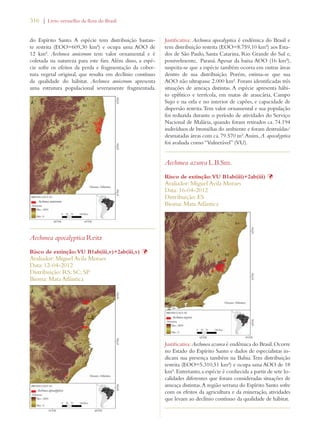
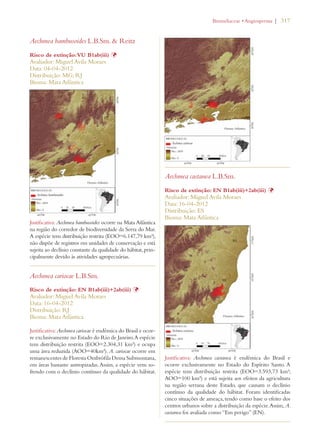
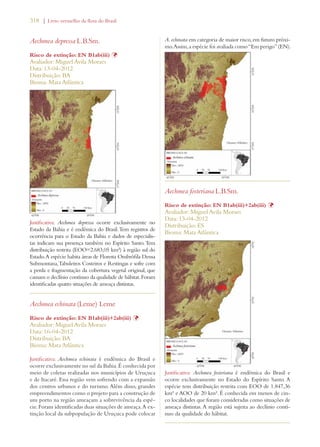
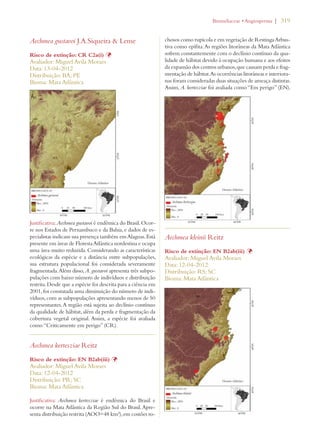
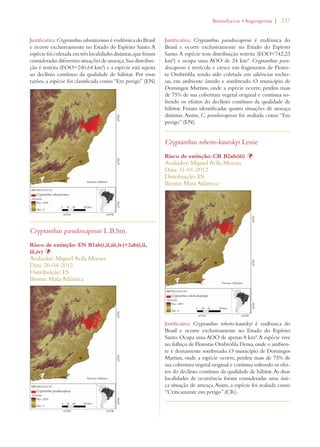
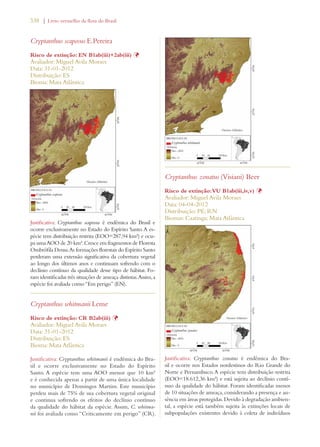
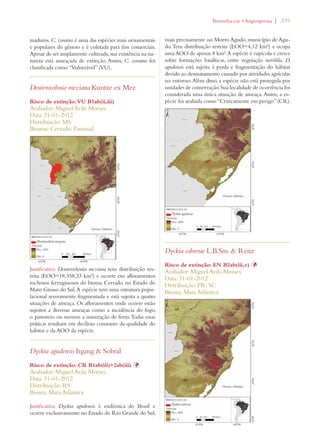
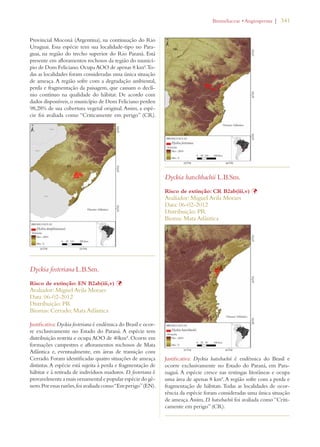
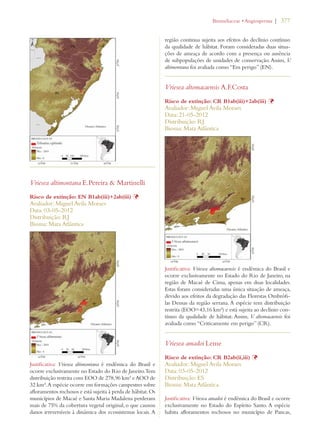
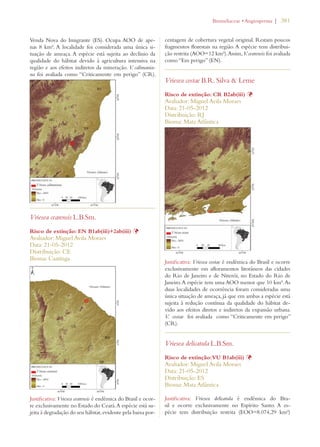
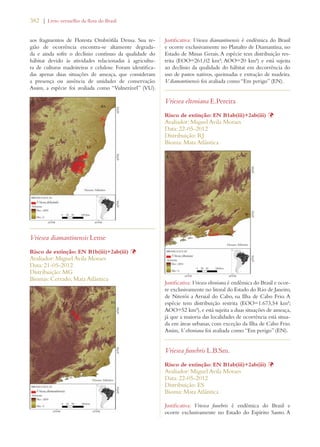
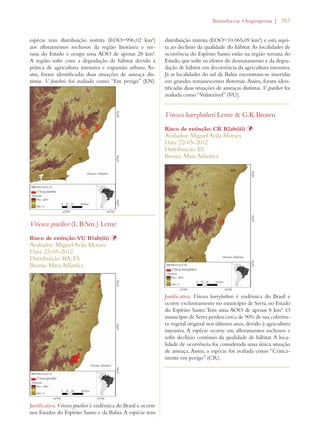
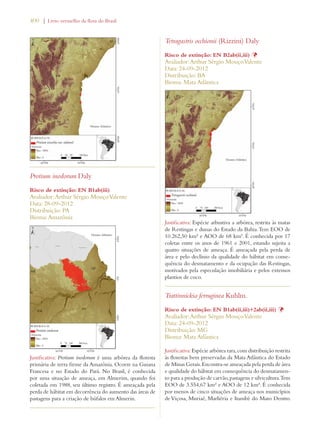
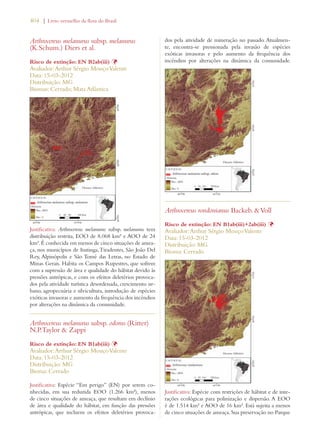
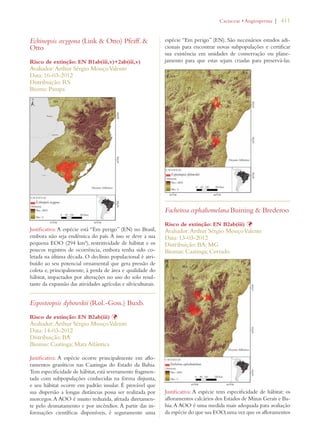
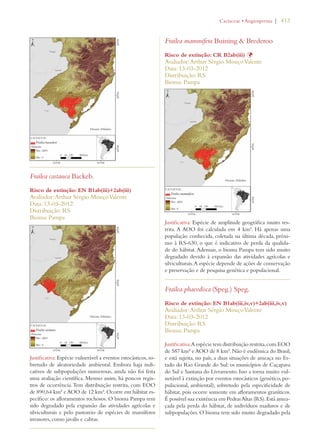
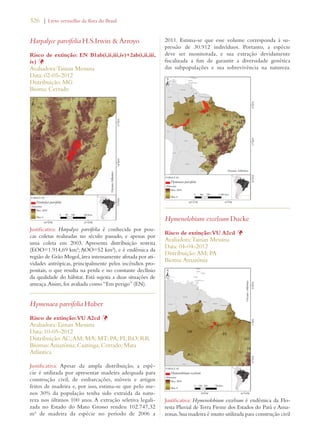
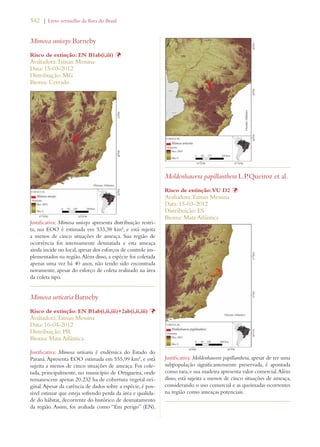
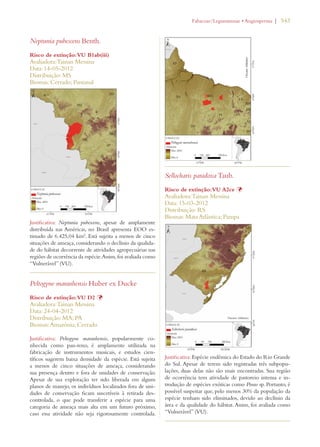
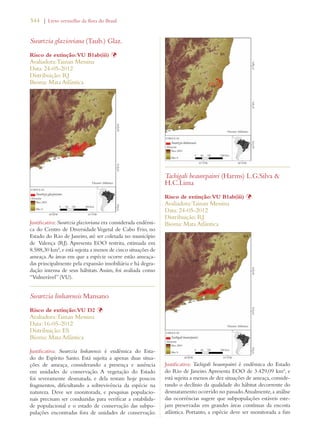
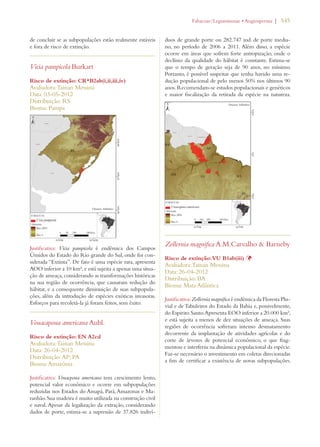
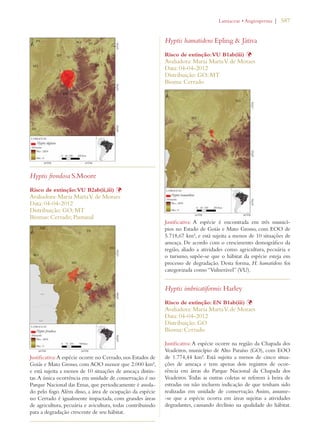
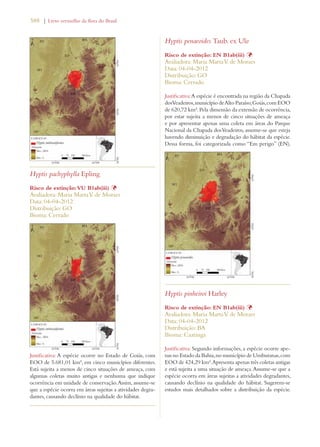
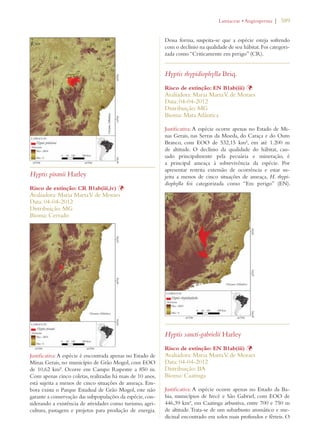
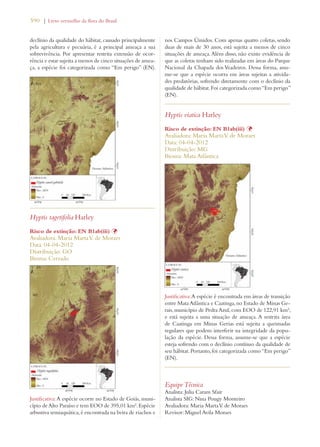
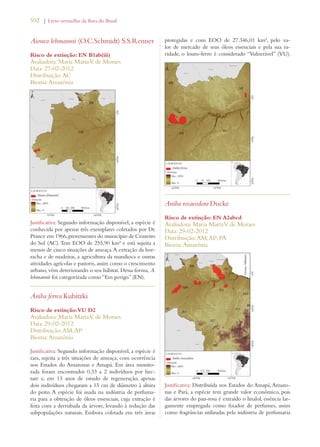
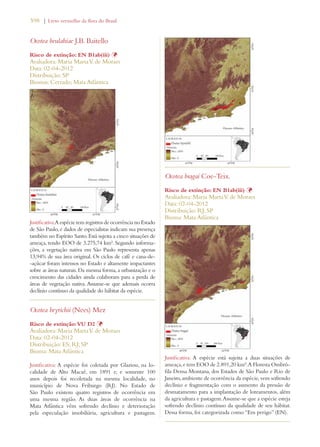
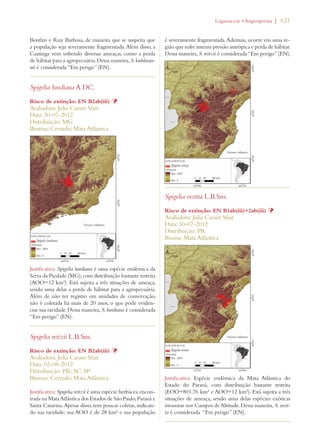
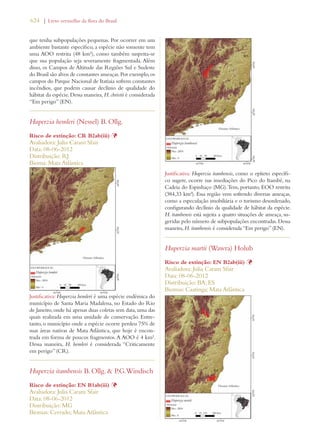
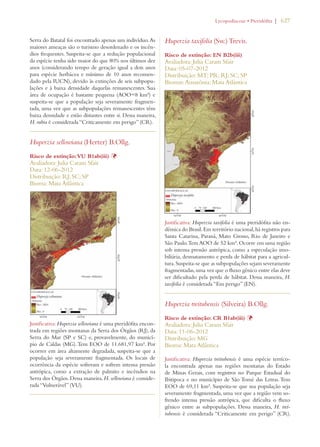
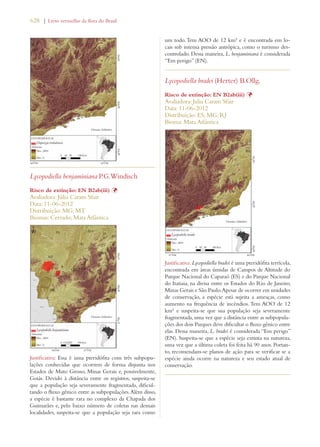
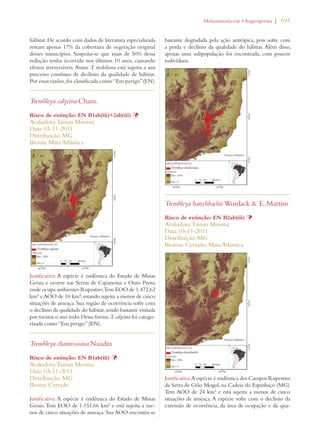
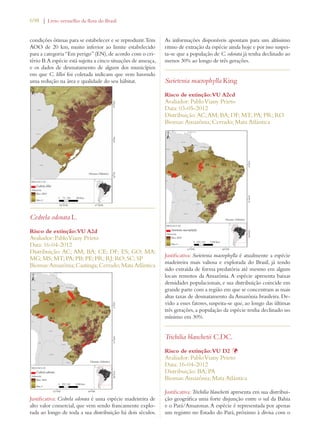
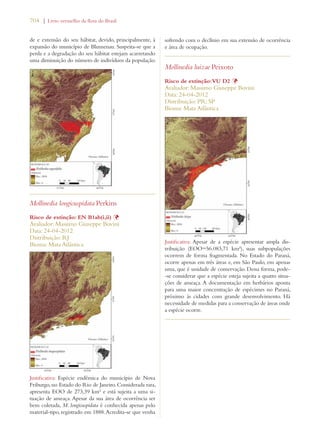
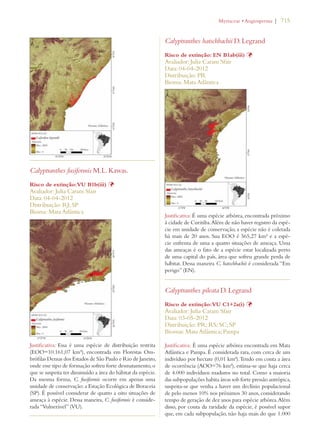
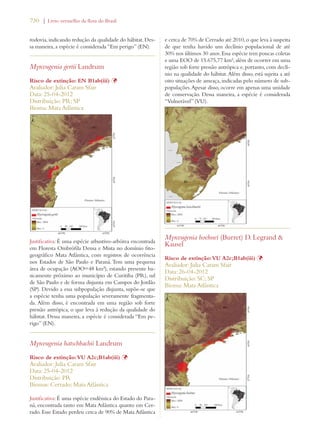
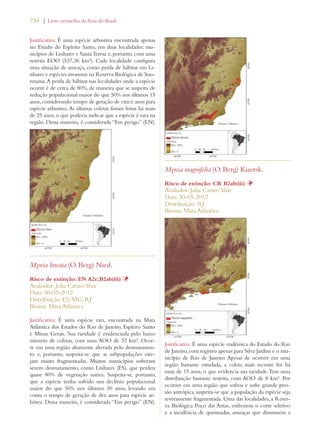
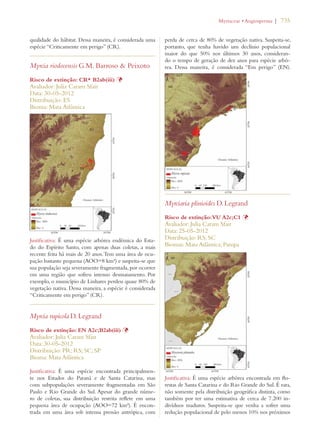
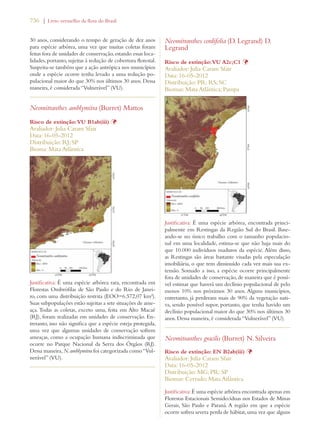
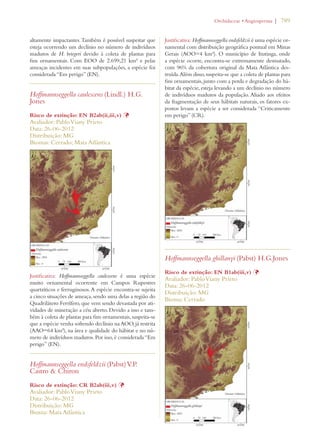
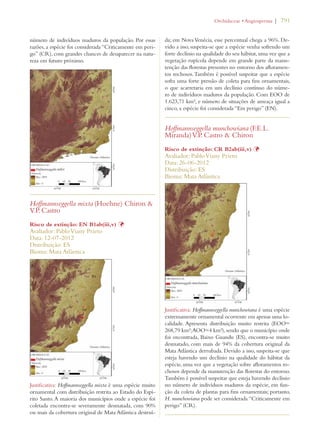
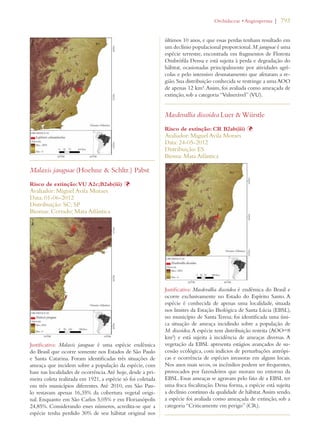
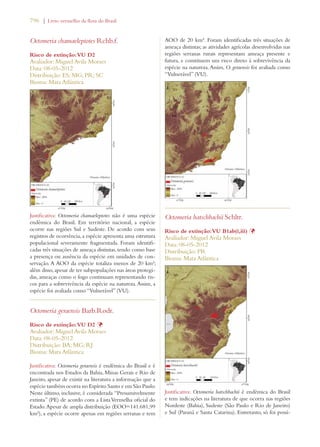
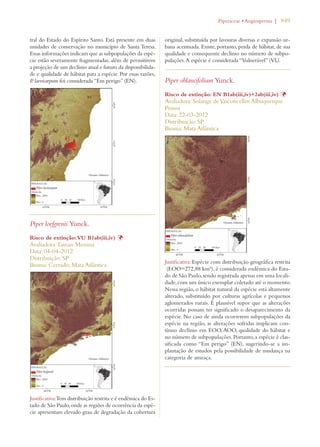
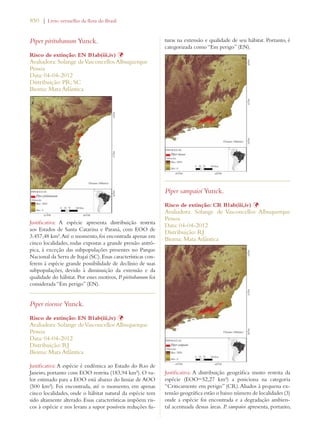
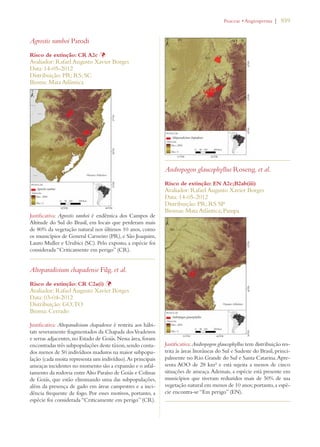
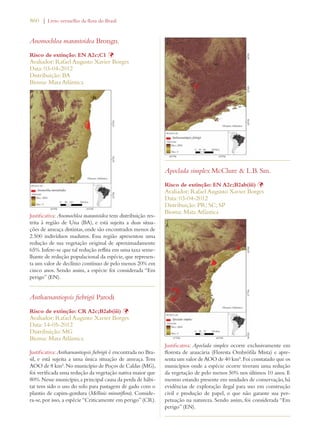
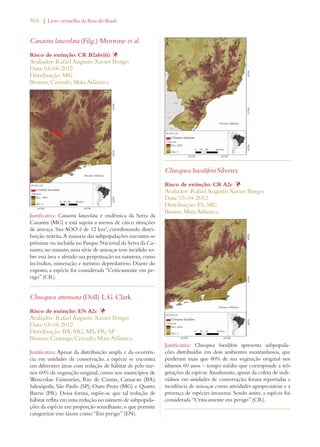
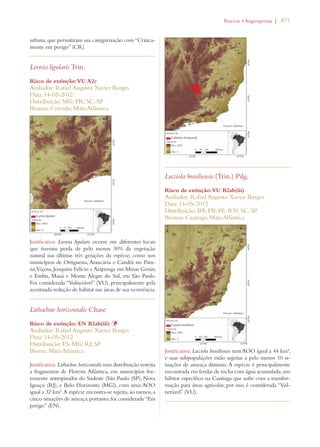
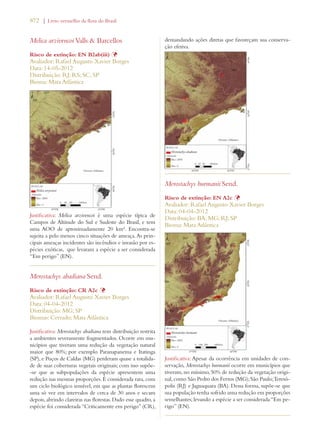
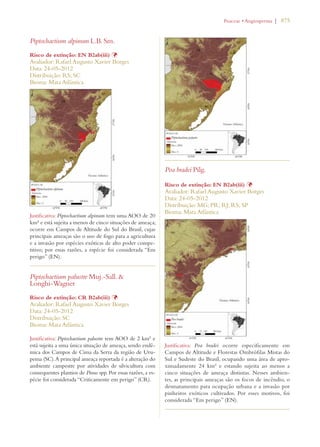
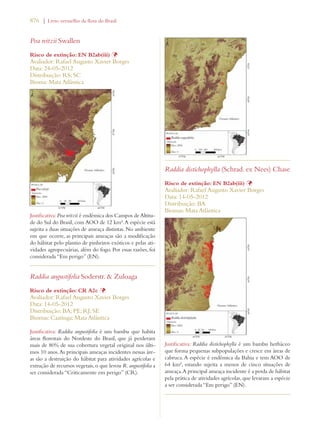
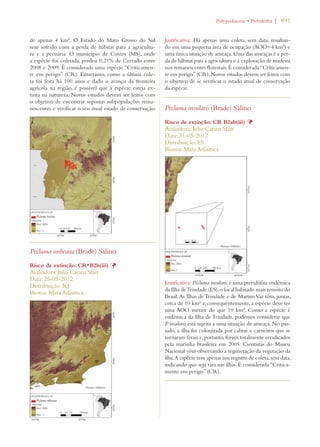
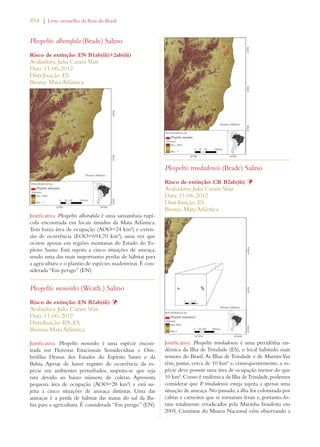
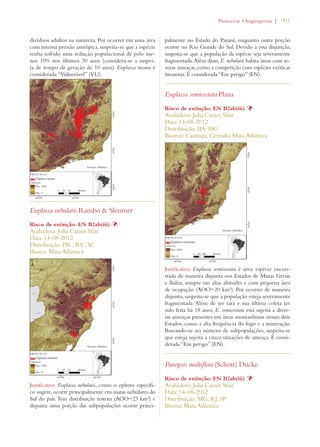
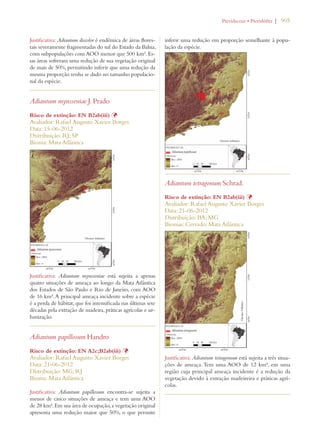
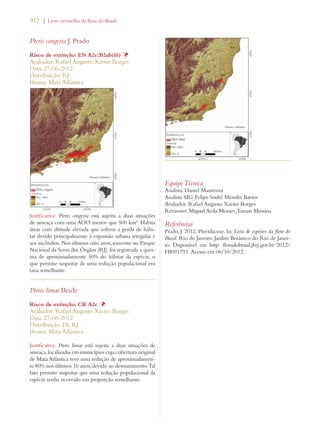
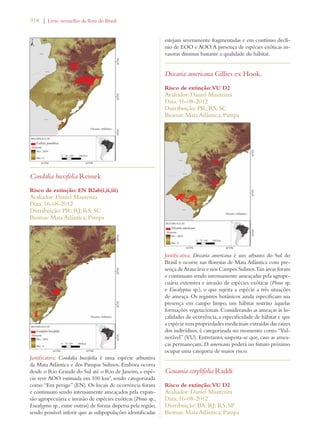
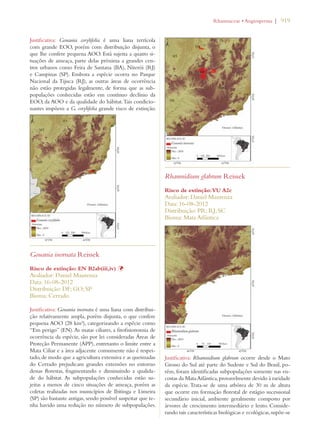
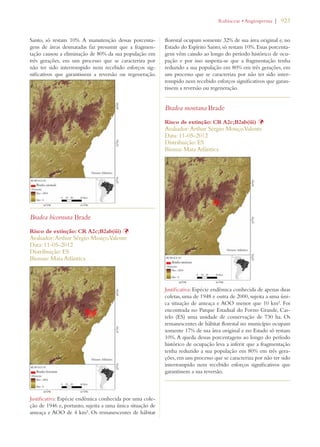
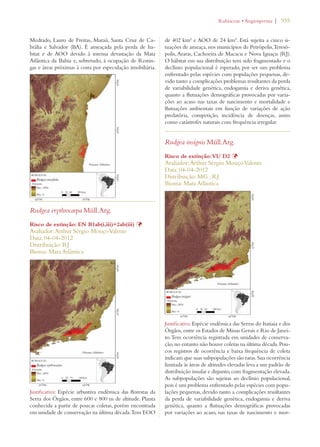
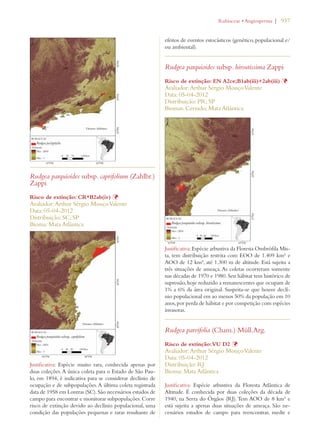
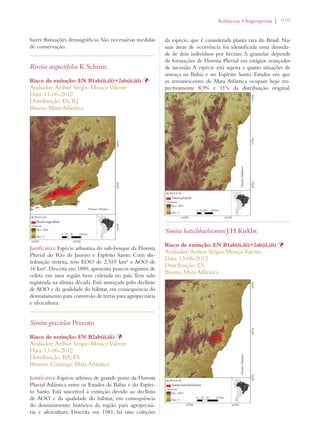
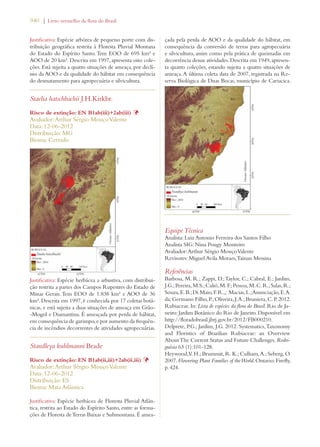
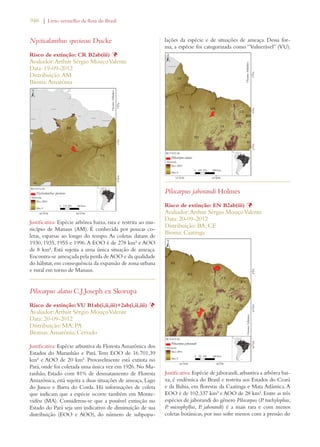
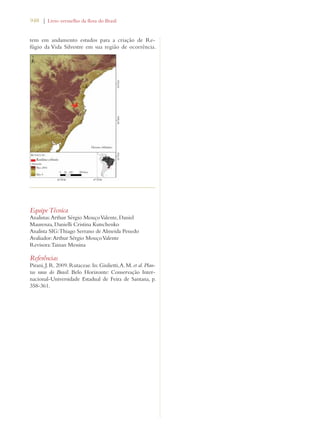
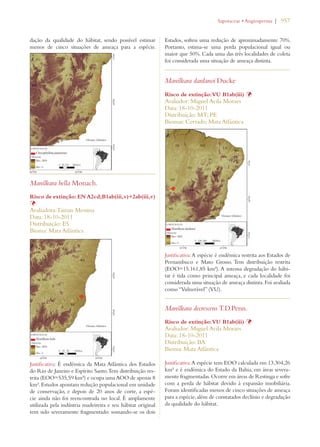
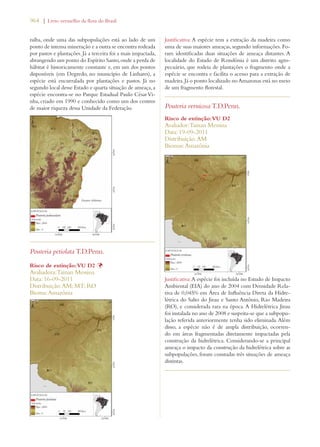
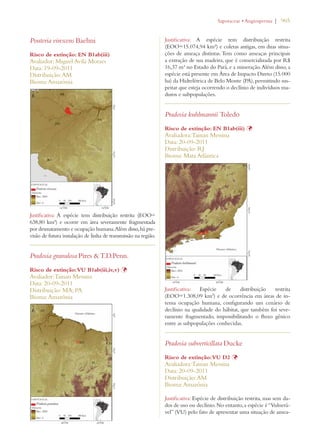
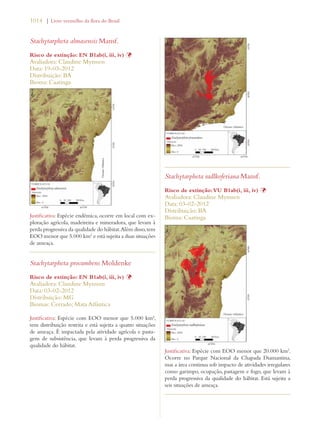
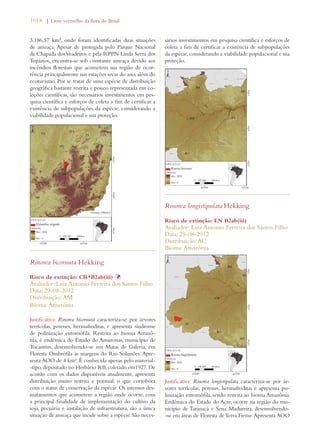
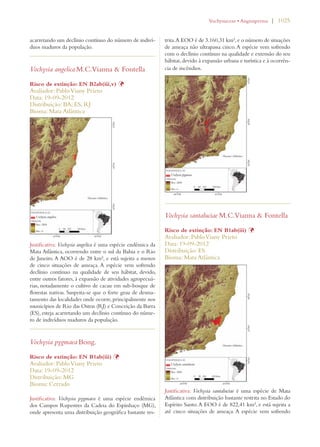
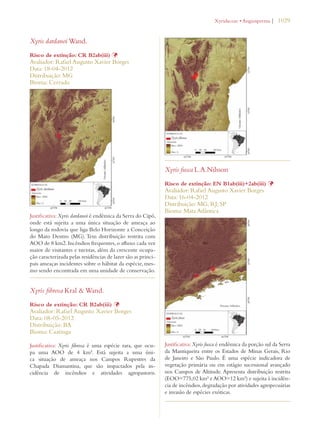
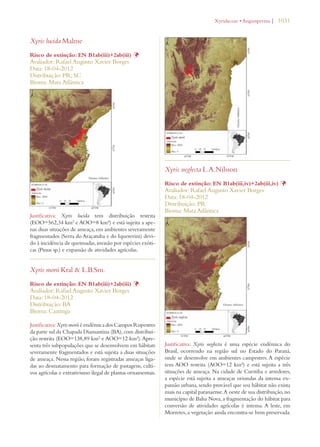
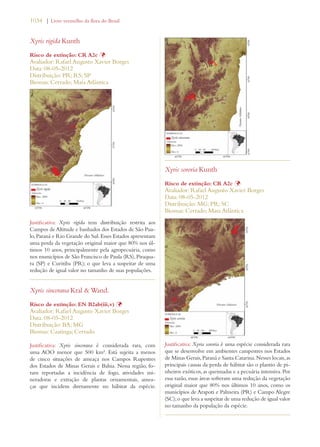
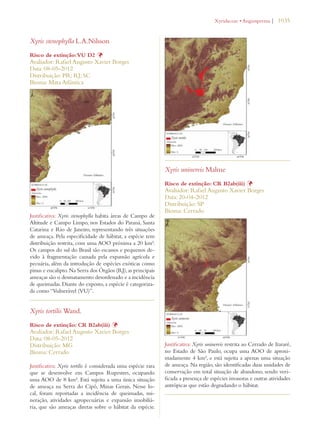
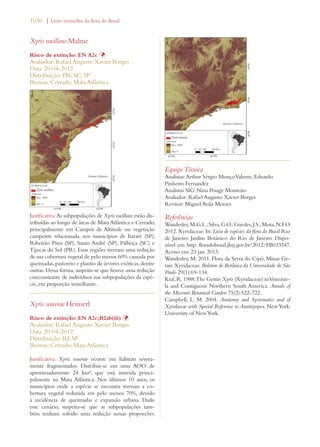
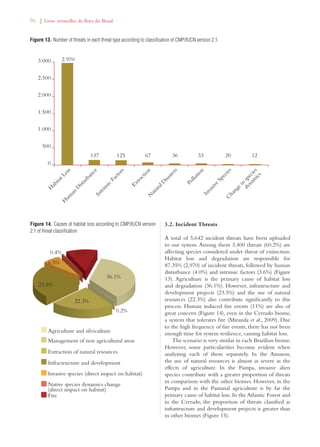
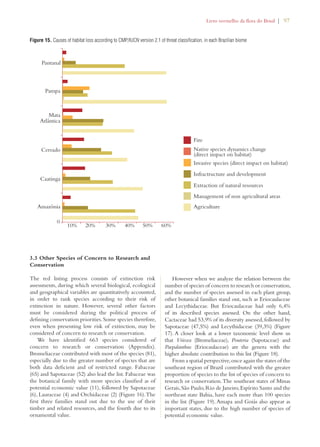
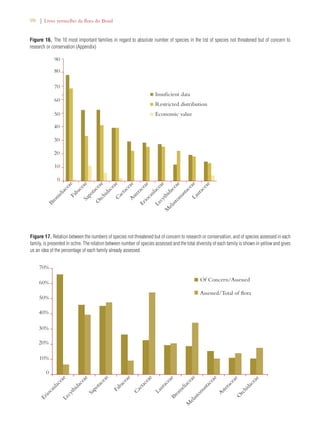
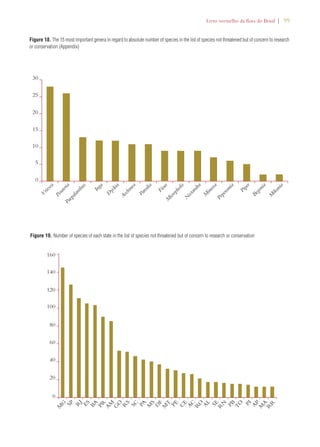
Este documento apresenta o Livro Vermelho da Flora do Brasil, que contém as avaliações de risco de extinção de espécies vegetais brasileiras. O livro foi organizado pelo Centro Nacional de Conservação da Flora e publicado pelo Instituto de Pesquisas Jardim Botânico do Rio de Janeiro para auxiliar na conservação da biodiversidade vegetal do país.


























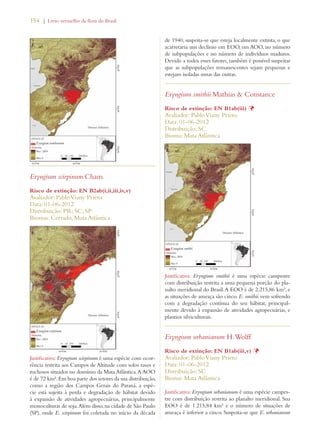
![26 | Livro vermelho da flora do Brasil
capítulo 2
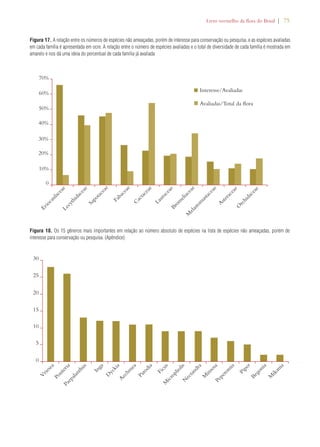
Desafios para a implementação da Estratégia Global
para a Conservação de Plantas no Brasil
Chapter 2
Challenges Facing Implementation of the Global Strategy for Plant Conservation
in Brazil
Braul i o F. de S ouza Dias Rob e rt Hof t 1
Em 2002, conservacionistas de flora celebra-ram
a adoção da Estratégia Global para a
Conservação de Plantas (Global Strategy for
Plant Conservation – GSPC, na sigla em inglês) na sexta
reunião da Conferência das Partes da Convenção sobre
Diversidade Biológica em Haia, nos Países Baixos.2 A
GSPC consiste em um conjunto de 16 metas comple-mentares,
voltadas para resultados, que demonstraram
ser um importante catalisador no estímulo à tomada
de ações por parte de países, organismos internacionais,
organizações voluntárias, doadores e, inclusive, o setor
privado. Ela forneceu aos cientistas e profissionais en-volvidos
com a taxonomia, com a conservação in situ e
ex situ, bem com a educação, um elo e uma voz no pro-cesso
político de gestão ambiental. Muitos observadores
consideram a GSPC uma história de successo: é condu-zida
por uma comunidade botânica ativa, conta com o
apoio dos principais jardins botânicos do mundo, e en-volve
tanto organizações governamentais quanto não-
-governamentais comprometidas com a conservação da
natureza, além de universidades e institutos de pesquisa.
A implementação da GSPC se dá por um mecanismo3
de coordenação flexível, que também monitora e avalia
o progresso, permitindo, com isso, que a Conferência
das Partes avalie os resultados de cada meta e faça ajus-tes
periódicos. Uma análise crítica dos avanços na rea-lização
dos objetivos propostos pela GSPC, conduzida
em 2008/9, concluiu que se havia conseguido, por um
lado, um avanço notável em metade das 16 metas e, por
outro, um limitado, superficial ou difícil de avaliar no
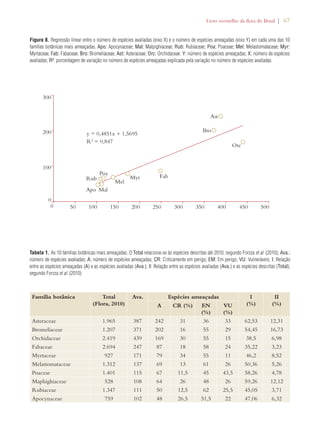
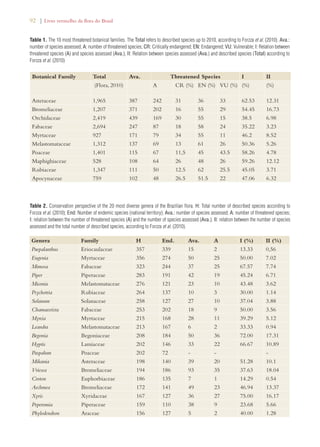
que tangia à outra metade (consultar Tabela 1). Com
base nessa análise, a décima reunião da Conferência
das Partes ajustou as metas de 2002, aprovando uma
Estratégia Global para a Conservação de Plantas revisa-da
e consolidada para o período de 2011 a 2020.4
Avaliações de risco de extinção para
nortear as ações de conservação
Apesar dos inúmeros avanços na realização das
metas originais da GSPC de 2002, as novas,
traçadas em 2010, são em geral mais ambiciosas,
reconhecendo, desse modo, o fato de que muitas
comunidades e espécies de plantas e suas interações
ecológicas, que incluem uma ampla gama de relações
entre elas e as culturas e comunidades humanas, correm
risco de extinção. De acordo com a análise da GSPC
2011-2020, se essa perda não for impedida, incontáveis
oportunidades de desenvolvimento de novas soluções
para problemas nos âmbitos econômico, social, sanitário
e industrial também se perderão.
A meta 2 é um exemplo de proposta reavaliada da
GSPC para o período de 2011 a 2020. Segundo ela:
“[É necessário] avaliar o estado de conservação de
todas as espécies de plantas conhecidas, na medida do
possível, para nortear as ações de conservação.” Já a
versão de 2002 fazia alusão às “avaliações preliminares”
em diferentes escalas geográficas (consultar detalhes na
Tabela 1). A implementação dessa meta é considerada
uma prioridade, uma vez que ela estabelece as bases para
a conservação de espécies ameaçadas in situ (metas 7 e
8) e para a definição de áreas prioritárias de conservação
(metas 5 e 10).5 Não obstante, menos de 10% das
espécies de plantas foram avaliadas mundialmente de
acordo com as Categorias e Critérios da Lista Vermelha
previstos na União Internacional para a Conservação da
Natureza (International Union for Conservation
of Nature – IUCN, na sigla em inglês).6 Alguns
especialistas em conservação consideram o processo da
IUCN por demais lento e complicado. Receiam que
continuaremos a perder espécies enquanto aguardamos
1. Secretariat of the Convention on Biological Diversity
2. Decisão VI/9 (http://www.cbd.int/decisions/?id=7183)
3. http://www.cbd.int/gspc/coordination.shtml
4. Decisão X/17 (http://www.cbd.int/decisions/?id=12283)
5. Para mais detalhes, consultar “Global Strategy for Plant Conserva-tion:
Technical Rationale, Justification for Updating and Suggested
Milestones and Indicators” (UNEP/CBD/COP/10/19) http://
www.cbd.int/doc/meetings/cop/cop-10/official/cop-10-19-en.doc
6. http://www.iucnredlist.org/technical-documents/categories-and-
-criteria](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-27-320.jpg)


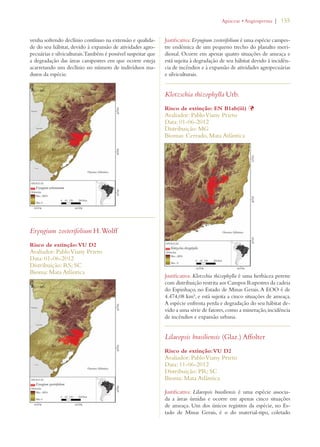
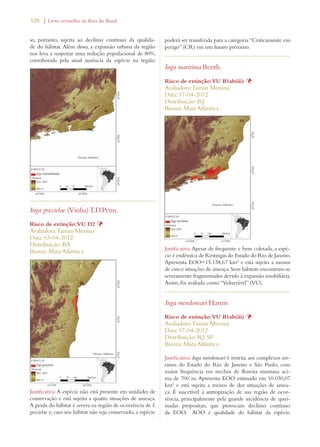
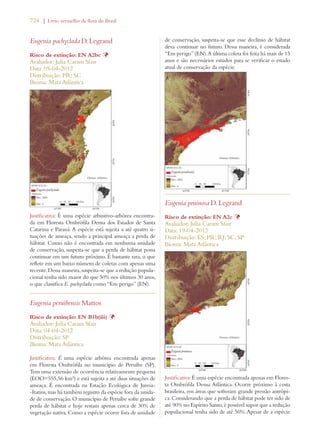
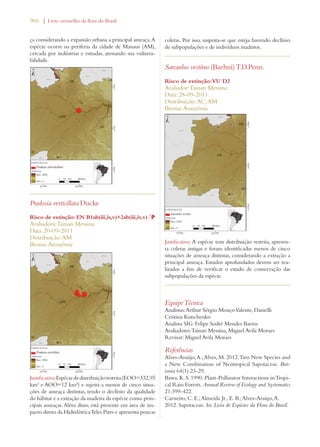
![Livro vermelho da flora do Brasil | 29
Meta 3: Desenvolvimento de
modelos com protocolos para a
conservação e o uso sustentável
de plantas, baseados em pesquisa
e em experiência prática
Meta 3.11: Incremento significativo nos investi-mentos
em estudos, projetos e pesquisa para o uso
sustentável da biodiversidade. Meta 4.7: Estímulo
a estudos biogeográficos que incluam predições
de ocorrência de espécies em associação a mudan-ças
climáticas potenciais, pelo uso de Sistemas de
Informação Geográfica.
Meta 6.2: Ampliação do acesso a informação de
qualidade sobre conservação, uso sustentável e re-partição
de benefícios da diversidade biológica.
Avanço significativo
[sobretudo no aumento
de pesquisa]
Conservação da diversidade de
plantas:
Meta 4: Conservação efetiva de
pelo menos 10% de cada uma das
regiões ecológicas do mundo
Meta 2.1: Pelo menos 30% do Bioma Amazônia
e 10% dos demais biomas e da Zona Costeira e
Marinha efetivamente conservados por Unidades
de Conservação do Sistema Nacional de Unidades
de Conservação (SNUC).
Meta 4.1: Redução na taxa de desmatamento de
100% no Bioma Mata Atlântica, de 75% no Bioma
Amazônia e de 50% nos demais biomas
Avanço notável
Meta 5: Proteção garantida de
50% das áreas mais importantes
para a diversidade de plantas
Meta 2.2: Proteção da biodiversidade assegurada
em pelo menos 2/3 das Áreas Prioritárias para
Biodiversidade por meio de Unidades do SNUC,
Terras Indígenas e Territórios Quilombolas.
Meta 2.13: Capacidade de ecossistemas de fornecer
bens e serviços mantida ou melhorada nas Áreas
Prioritárias para Biodiversidade.
Avanço significativo
Meta 6: Administração direcio-nada
à conservação da diversida-de
de plantas de pelo menos 30%
das terras produtivas
Meta 2.14: Aumento significativo das ações de
apoio à conservação on farm dos componentes da
Agrobiodiversidade que garantam a manutenção
dos modos de vida sustentáveis, segurança alimen-tar
local e saúde, especialmente para comunidades
locaise povos indígenas.
Meta 3.13: Apoio da CCZEE para a elaboração
e conclusão de ZEEs em pelo menos 50% dos
Estados.
Meta 4.2: Redução média de 25% no número de
focos de calor em cada bioma.
Meta 4.6: 50% das fontes de poluição das águas e
solos e seus impactos sobre a biodiversidade con-trolados.
Avanço significativo
[sobretudo na redução de
fogo e no aumento do
zoneamento ecológico-
-econômico (ZEE/Eco-logical
and Economic
Zoning)
Meta 7: Conservação in situ de
60% das espécies ameaçadas no
mundo
Meta 2.4: Todas as espécies reconhecidas oficial-mente
como ameaçadas de extinção no país con-templadas
com Planos de Ação e Grupos Assessores
ativos.
Meta 2.5: 100% das espécies ameaçadas efetiva-mente
conservadas em Áreas Protegidas.
Meta 2.6: Redução de 25% na taxa anual de in-cremento
de espécies da fauna ameaçadas na Lista
Nacional e retirada de 25% de espécies atualmente
na Lista Nacional.
Avanço limitado](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-30-320.jpg)
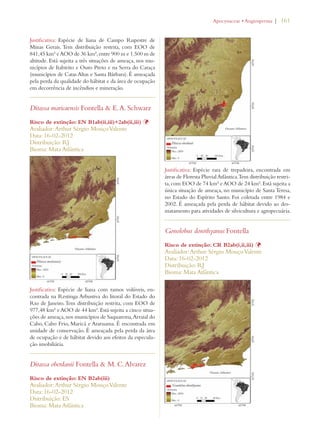
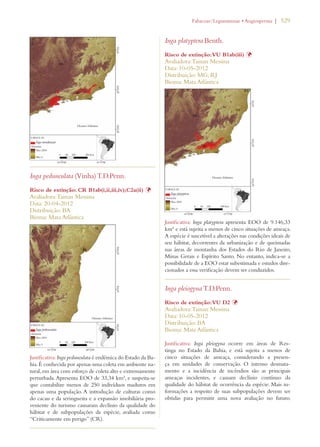
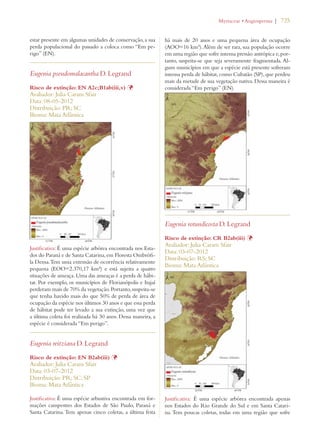
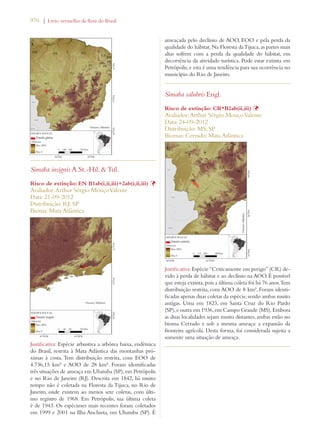
![30 | Livro vermelho da flora do Brasil
Meta 8: Disponibilização de 60%
das espécies ameaçadas de plantas
em coleções ex situ, de preferên-cia
no país de origem, e inclusão
de 10% delas em programas de
recuperaçao e reintrodução
Meta 2.8: 60% das espécies de plantas ameaçadas
conservadas em coleções ex situ e 10% das espécies
de plantas ameaçadas incluídas em programas de
recuperação e restauração.
Avanço limitado
Meta 9: Conservação de 70% da
diversidade genética de cultivos
e outras espécies principais de
plantas valiosas socioeconomica-mente
conservadas, e preservação
do conhecimento local
Meta 2.10: 70% da diversidade genética de plantas
cultivadas e extrativas de valor socioeconômico
conservadas, e o conhecimento indígena e local
associado mantido
Meta 2.12: 60% da diversidade genética dos paren-tes
silvestres brasileiros de plantas cultivadas de 10
gêneros prioritários efetivamente conservados in
situ e/ou ex situ.
Avanço limitado
Meta 10: Efetivação de planos
de controle de pelo menos 100
das principais espécies exóticas
invasoras que ameaçam as plantas,
as comunidades de flora e os há-bitats
e ecossistemas associados
Meta 4.4: Todas as espécies no Diagnóstico Nacio-nal
de Espécies Exóticas Invasoras com Plano de
Ação de Prevenção e Controle elaborado.
Meta 4.5: Planos de manejo implementados para
controlar pelo menos 25 das principais espécies
exóticas invasoras que mais ameaçam os ecossiste-mas,
hábitats ou espécies no país.
Avanço limitado
Uso sustentável da
biodiversidade de plantas:
Meta 11: Nenhuma espécie de
flora silvestre ameaçada pelo
comércio internacional
Meta 3.6: Nenhuma espécie da fauna ou flora
silvestre ameaçada pelo comércio internacional, em
cumprimento ao disposto pela CITES.
Meta 3.7: Redução significativa do comércio ilegal
de espécies da fauna e flora no país.
Meta 3.10: Aumento significativo das ações de
detecção, controle e repressão dos casos de biopi-rataria.
Avanço limitado
Meta 12: 30% de produtos à base
de plantas oriundos de fontes ad-ministradas
de forma sustentável
Meta 3.1: 30% de produtos vegetais não-madei-reiros
provenientes de fontes manejadas de forma
sustentável.
Meta 3.3: 40% da área com Plano de Manejo Flo-restal
na Amazônia Certificada.
Meta 3.4: 80% das Reservas Extrativistas e Reser-vas
de Desenvolvimento Sustentável com manejo
sustentável de espécies da fauna e da flora de inte-resse
alimentar ou econômico assegurados e com
seus planos de manejo elaborados e implementados.
Meta 3.5: 80% de redução no consumo não
sustentável de recursos faunísticos e florísticos em
unidades de conservação de uso sustentável.
Meta 5.6: Benefícios resultantes do uso comercial
dos recursos genéticos efetivamente repartidos de
forma justa e equitativa em prol da conservação da
biodiversidade.
Avanço limitado
[dados insuficientes em
alguns casos]](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-31-320.jpg)


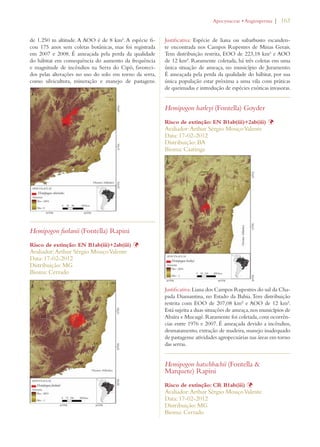
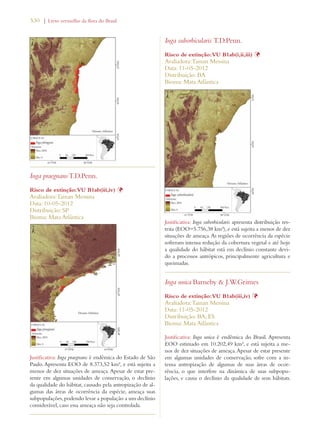
![34 | Livro vermelho da flora do Brasil
Promoting education and awareness about plant diversity:
Target 14: The importance of plant diversity and the need for its conserva-tion
incorporated into communication, educational and public-awareness
programs
Notable progress
Building capacity for the conservation of plant diversity:
Target 15: The number of trained people working with appropriate facilities
in plant conservation increased, according to national needs, to achieve the
targets of this Strategy
Notable progress
Target 16: Networks for plant conservation activities established or strength-ened
at national, regional and international levels
Notable progress
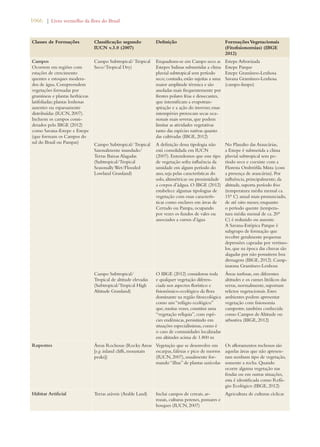
A summary of the progress accomplished so far in
Brazil in implementing the GSPC targets is presented
below (Table 2) according to the review of the National
Biodiversity Targets (MMA 2006) conducted by the
National Commission on Biodiversity (CONABIO) and
documented in Chapter 4 of the 4th National Report of
Brazil to the CBD (MMA 2011a).
Table 2. Summary assessment of progress made in achieving GSPC targets in Brazil conducted as part of the in-depth review in the 4th
National Report of Brazil to the CBD11
Objectives (bold italics) and targets
of the Global Strategy for Plant
Conservation 2002-2010
Equivalent or Related National Targets12 Assessment of progress
made in achieving GSPC
targets13
Understanding and documenting
plant diversity:
Target 1: A widely accessible work-ing
list of known plant species, as a
step towards a complete world flora
Target 1.1: An expanded and accessible list
of formally described species of Brazilian
plants and vertebrates, and of invertebrates
and micro-organisms, these possibly selec-tively
developed, in the form of permanent
databases.
Notable progress
Target 2: A preliminary assess-ment
of the conservation status of
all known plant species, at national,
regional and international levels
Target 2.7: A preliminary national-level
assessment of the conservation status of all
known plant and vertebrate species and a
selective assessment of invertebrate species
carried out.
Limited progress
Target 3: Development of models
with protocols for plant conservation
and sustainable use, based on research
and practical experience
Target 3.11: Significant increase of invest-ment
in studies, projects and research on the
sustainable use of biodiversity.
Target 4.7: Support provided to biogeo-graphic
studies to include the predictabil-ity
of species occurrence associated with
potential climate changes using Geographic
Information Systems.
Target 6.2: Increased access to high quality
information on conservation, sustainable use
and sharing of benefits of biodiversity.
Significant progress [spe-cially
increase in research]
11. Brazil, 2011. Fourth National Report to the Convention on
Biological Diversity. Brasília: Ministry of the Environment, 248 p.
12. Brazil, 2006. National Biodiversity Targets. Brasília: National
Biodiversity Commission (Conabio), Resolution no. 3
13. Brazil, 2011. Progress towards the 2010 Target, pp.149-184 In:
Fourth National Report to the Convention on Biological Diversity. Brasília,
Ministry of the Environment, 248 p.](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-35-320.jpg)
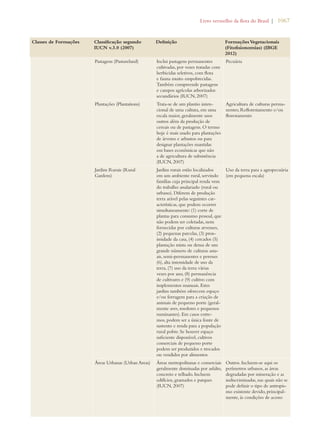
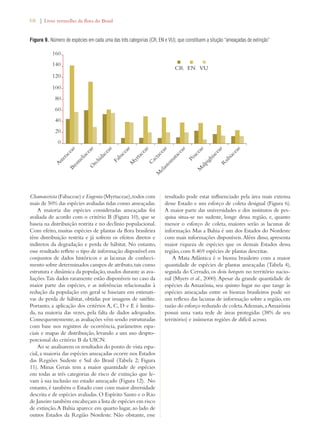
![Livro vermelho da flora do Brasil | 35
Conserving plant diversity:
Target 4: At least 10% of each of the
world’s ecological regions effectively
conserved
Target 2.1: At least 30% of the Amazon
biome and 10% of the remaining biomes
and the coastal and marine zone effectively
conserved through protected areas within the
National Protected Areas System (SNUC).
Target 4.1: 100% reduction in the rate of
deforestation in the Atlantic Forest biome,
75% in the Amazon biome and 50% in
remaining biomes.
Notable progress
Target 5: Protection of 50% of the
most important areas for plant diver-sity
assured
Target 2.2: Protection of biodiversity guar-anteed
in at least 2/3 of the Priority Areas for
Biodiversity by means of SNUC Protected
Areas, Indigenous Lands, and Quilombola
[Maroon] Territories.
Target 2.13: Capacity of ecosystems within
Priority Areas for Biodiversity to deliver
goods and services maintained or increased.
Significant progress
Target 6: At least 30% of production
lands managed consistent with the
conservation of plant diversity
Target 2.14: Significant increase in actions to
support on-farm conservation of the com-ponents
of agrobiodiversity that ensure the
maintenance of sustainable livelihoods, local
food security and health care, especially for
local communities and indigenous peoples.
Target 3.13: Support of the Commission for
Coordination of Ecological and Economic
Zoning for the preparation and conclusion of
ecological and economic zoning plans for at
least 50% of Brazilian states.
Target 4.2: Overall reduction of 25% in the
number of fires (heat sources) in each biome.
Target 4.6: 50% of sources of water and soil
pollution and their impacts on biodiversity
controlled.
Significant progress [spe-cially
in reduction of fires
and increasing ecological
and economic zoning]
Target 7: 60% of the world’s threat-ened
species conserved in situ
Target 2.4: All species officially recognized as
threatened with extinction in Brazil as object
of action plans and active advisory groups.
Target 2.5: 100% of threatened species ef-fectively
conserved in protected areas.
Target 2.6: 25% reduction in the annual rate
of increase of threatened species of fauna on
the National List and de-listing of 25% of
species currently on the National List.
Limited progress
Target 8: 60% of threatened plant
species in accessible ex situ collec-tions,
preferably in the country of
origin, and 10% of them included in
recovery and restoration programs
Target 2.8: 60% of threatened plant species
conserved in ex situ collections and 10% of
threatened plant species included in recovery
and restoration programs.
Limited progress](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-36-320.jpg)
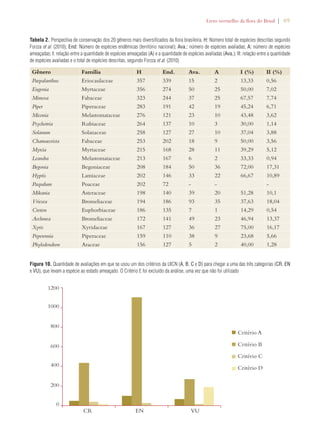
![36 | Livro vermelho da flora do Brasil
Target 9: 70% of the genetic diver-sity
of crops and other major socio-economically
valuable plant species
conserved, and associated indigenous
and local knowledge maintained
Target 2.10: 70% of the genetic diversity of
socio-economically valuable cultivated or
exploited wild plant species and associated
indigenous and local knowledge maintained.
Target 2.12: 60% of the genetic diversity of
Brazilian wild relatives of cultivated plant
species of the ten priority genera effectively
conserved in situ and/or ex situ.
Limited progress
Target 10: Management plans in
place for at least 100 major alien
species that threaten plants, plant
communities and associated habitats
and ecosystems
Target 4.4: Action plans for prevention and
control prepared for all species listed under
the National Assessment of Alien Invasive
Species.
Target 4.5: Management plans implemented
for the control of at least 25 of the main in-vasive
alien species that threaten ecosystems,
habitats or species in Brazil.
Limited progress
Using plant diversity sustainably:
Target 11: No species of wild flora
endangered by international trade
Target 3.6: No species of wild fauna or flora
endangered by international trade in accor-dance
with CITES provisions.
Target 3.7: Significant reduction in illegal
trade of fauna and flora species within Brazil.
Target 3.10: Significant increase in the de-tection,
control and repression of bio-piracy.
Limited progress
Target 12: 30% of plant-based prod-ucts
derived from sources that are
sustainably managed
Target 3.1: 30% of non-timber plant prod-ucts
obtained from sustainably managed
sources. Target 3.3: 40% of the area in the
Amazon under forest management plans
certified. Target 3.4: 80% of Extractive
Reserves and Sustainable Development Re-serves
benefit from sustainable management
of fauna and flora species important for food
or economically, with management plans
prepared and implemented.
Target 3.5: 80% reduction in the unsustain-able
consumption of fauna and flora resourc-es
in sustainable development protected areas.
Target 5.6: Benefits resulting from com-mercial
utilization of genetic resources shared
effectively, fairly and equitably in support of
biodiversity conservation.
Limited progress [insuf-ficient
information in some
cases]](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-37-320.jpg)






![Livro vermelho da flora do Brasil | 43
dólares por táxon (W. Darwall, dados não publicados),
ao passo que a Lista Vermelha Europeia, que avaliou 5.600
taxa, igualmente de diversos grupos taxonômicos, custou
239 dólares por táxon (M. Biltz, dados não publicados).
Outras estimativas do custo de condução de avaliação de
plantas chegam a aproximadamente 440 dólares por táxon
(Stuart et al., 2010); não obstante, o custo da avaliação
da África do Sul aproximou-se dos valores tipicamente
incorridos quando há grande contribuição voluntária nas
avaliações. Por exemplo, a Avaliação Global de Cicadáceas
(Global Cycad Assessment), conduzida pelo Grupo de
Especialistas em Cicadáceas da SSC/IUCN (IUCN/SSC
Cycad Specialist Group) custou aproximadamente 26
dólares por táxon (J. Donaldson, dados não publicados).
No caso dessas avaliações, o valor das contribuições
voluntárias não foi estimado, o que ressalta o custo baixo
real associado às avaliações sul-africanas. Uma avaliação
de famílias de plantas selecionadas em Madagascar custou,
até o momento, menos que 30 dólares por táxon (Schatz,
2009). Desse modo, prevemos que as avaliações de plantas
em outros países megadiversos em desenvolvimento
também possam ser feitas a baixo custo. Na África do Sul,
o custo das avaliações diminuiu com o tempo, baixando
de 158,25 dólares no primeiro ano (2004) para 39,72
no último ano de avaliação (2008). Tal fato se deveu à
experiência adquirida pelos avaliadores ao longo do
projeto, que permitiu que avaliassem mais espécies em
um período de tempo mais curto. No Brasil, espera-se
que o mesmo aconteça, porém mais por causa da redução
nos investimentos em infraestrutura e do aumento da
capacitação.
D. Avaliações completas asseguram que uma
proporção maior de flora se torne foco de
atenção conservacionista
Todas as listas vermelhas elaboradas anteriormente na
África do Sul avaliaram apenas uma pequena proporção
(menos de 20%) da flora nativa. Como resultado da
primeira avaliação completa de todos os 20.456 táxons,
2.045 táxons de interesse para conservação foram
acrescidos à lista vermelha pela primeira vez. Desses, 942
estavam ameaçados de extinção. A maioria deles já era, do
ponto de vista histórico, de interesse para conservação,
porém nunca tinha sido avaliada antes. Muitos táxons
ameaçados ou de interesse para conservação são
negligenciados quando se conduzem apenas avaliações
seletivas.
Um argumento usado com frequência contra as
avaliações completas é que seria um desperdício de
esforço tentar avaliar todas as espécies, quando ainda se
conhece pouquíssimo a respeito da maioria para que se
tenham dados que permitam sua análise de acordo com
os critérios. A condução de uma avaliação completa
permitiu que a África do Sul identificasse quais eram
as principais lacunas de conhecimento botânico, o que
levou à priorização da pesquisa taxonômica (Von Staden
et al., 2013).
Ao se comparar a proporção de táxons ameaçados
na África do Sul com os de outros países megadiversos,
o impacto de programas de avaliação sólidos é notório.
Esse país, tal como outros megadiversos que conduziram
avaliações de táxons endêmicos usando as Categorias
e Critérios da IUCN, versão 3.1, apresentam uma alta
proporção (10 %) de táxons ameaçados. Outros países
megadiversos, tais como a Austrália (20.148 taxa) e
o Brasil (43.448 taxa), que ainda não levaram a efeito
programas de avaliação sólidos, sinalizaram porcentagens
bem menores de sua flora como ameaçadas, somente 4%
e 1%, respectivamente (Chapman, 2009; [Floradobrasil];
Griffin Hilton-Taylor, 2008). Por esse motivo, o Brasil
decidiu iniciar uma avaliação completa de toda a sua
flora. A apresentada nesta obra é o primeiro estágio desse
projeto e abarca as avaliações padronizadas de acordo com
as Categorias e Critérios da IUCN, versão 3.1, das espécies já
incluídas em diferentes versões da lista vermelha oficial,
publicada pelo Ministério do Meio Ambiente.
Conclusão
A experiência sul-africana demonstra que é possível
avaliar um grupo extenso de táxons, tal qual a
flora de um país megadiverso, usando o padrão
internacional do sistema da lista vermelha da IUCN. As
lições aprendidas nesse processo foram compartilhadas
com os brasileiros e usadas para desencadear o processo
de avaliação do risco de extinção da flora do Brasil. A
metodologia adotada pode ser empregada por outros
países megadiversos, poupando gastos e ajudando a
tornar o processo de avaliação de risco de extinção
da flora mais impactante para as ações de conservação
locais. Em geral, esse processo teve um impacto
positivo nos esforços conservacionistas e permitiu
que a África do Sul confrontasse seus relatórios com
indicadores globais. Como resultado, o Brasil investiu
no desenvolvimento de um sistema de informações para
garantir o gerenciamento de dados e facilitar o processo
de elaboração de lista vermelha. Encorajamos outros
países megadiversos a conduzir avaliações completas do
estado de conservação, sobretudo de plantas, usando o
sistema da IUCN, versão 3.1.](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-44-320.jpg)




![48 | Livro vermelho da flora do Brasil
specimens represented in the National Herbarium. In
Brazil, 18.1% or 855 taxa of 4,617 assessed up to now,
have fewer than five specimens represented in botanical
collections. Despite this lack of good data it was possible
to assign all South African and Brazilian plant taxa to one
of the IUCN categories. Most assessments were done
with only three basic information sources: taxonomic
literature, electronic herbarium specimen data and spatial
land cover data.
Threatened species tend to be concentrated in specific
areas where high levels of endemism coincide with high
levels of threat, especially land use impacts. Many species
with similar distribution ranges and habitats are thus
facing similar threats. Experienced assessors were able to
use their knowledge from assessing well known species
to infer the status of poorly known species from similar
regions and habitats. Understanding the impact of local
threats on particular plant life histories and ecological
processes was central to this process.
C. Costs and cost saving recommendations
The South African Red List cost US$593,291 to assess
20,456 taxa, at an average cost of US$29 per taxon.
While the Brazilian Red List cost US$460,000 to assess
4,617 taxa up to now, at an average cost of US$49.82 per
taxon. This is cheap when compared to other regional
assessment projects. The African Fresh Water Assessment
that assessed 5000 taxa from a range of taxonomic groups
cost US$383.87 per taxon (W. Darwall, unpublished
data), while the European Red List, which assessed 5,600
taxa, also from varying taxonomic groups, cost US$239
per taxon (M. Biltz, unpublished data). Other estimates
of the cost of conducting plant assessment are as high
as c. US$440 per taxon (Stuart et al., 2010), but the
cost of the South African assessment was closer to the
costs typically incurred when there is a large volunteer
contribution to assessments. For example, the Global
Cycad assessment, conducted by the IUCN/SSC Cycad
Specialist Group, cost c. US$26 per taxon (J. Donaldson,
unpublished data). In the case of the Cycad assessment
the volunteer contribution has not been costed, which
emphasizes the low real cost associated with the South
African assessment. An assessment of selected plant
families in Madagascar has to date cost under US$30 per
taxon (Schatz, 2009). We thus predict that assessments
of plants in other developing megadiverse countries
could also be done as cheaply. In South Africa, the cost
of assessments decreased with time from US$158.25 in
the first year of assessment (2004) to US$39.72 in the
final year (2008). This was due to experience gained by
assessors over the course of the project, which increased
their ability to assess more species in a shorter time.
In Brazil, we expect the same to happen, related more
however to reduction on investments in infrastructure
and increasing capability.
D. Comprehensive assessments ensure conservation
attention for a greater proportion of flora
All previous red lists conducted in South Africa evaluated
only a small proportion (less than 20%) of the indigenous
flora. As a result of the first comprehensive assessment
of all 20,456 taxa, 2,045 of conservation concern were
added to the red list for the first time. Of these 942
were taxa threatened with extinction. The majority of
these were historically of conservation concern, but
were never previously assessed. Many threatened taxa
and other taxa of conservation concern are overlooked
when only selective assessments are done.
An argument often used against comprehensive
assessments is that it is a waste of effort to try and assess
all species when most are too poorly known to obtain
enough data to measure against the criteria. Conducting
a comprehensive assessment has allowed South Africa to
identify where the major botanical knowledge gaps are,
and has led to the prioritization of taxonomic research
(Von Staden et al., 2013).
When comparing the proportion of threatened taxa
in South Africa to those in other megadiverse countries,
the impact of substantive assessment programs becomes
clear. South Africa, like other megadiverse countries that
have conducted IUCN assessments of endemic taxa
using the IUCN 3.1 Categories and Criteria, has a high
proportion (10 %) of taxa that are threatened. Other
megadiverse countries such as Australia (20,148 taxa)
and Brazil (43,448 taxa) that have not yet undertaken
substantive assessment programs have identified far lower
proportions of their floras as threatened, only 4% and
1% respectively (Chapman, 2009; [Floradobrasil]; Griffin
Hilton-Taylor, 2008). And for this reason, Brazil has
decided to initiate a comprehensive evaluation of the
entire flora, assessments presented here are the first stage
of this project and represent standardized assessments
using the IUCN 3.1 Categories and Criteria of those
species already included in the official red list.
Conclusion
The South African experience shows that it is possible
to assess a large group of taxa, such as the flora of a
megadiverse country, using the international standard of
the IUCN Red List system. The lessons learned from this
process were shared with the Brazilians, and used to trigger
a national red listing process in Brazil. The approaches
adopted can be used by other megadiverse countries as
these will confer cost savings on similar projects, and can
help to make the red listing process more meaningful for
local conservation action. Overall, the red listing process
has had a positive impact on conservation efforts and is
enabling South Africa to report against some of the global
indicators. As a result, Brazil has invested in developing](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-49-320.jpg)














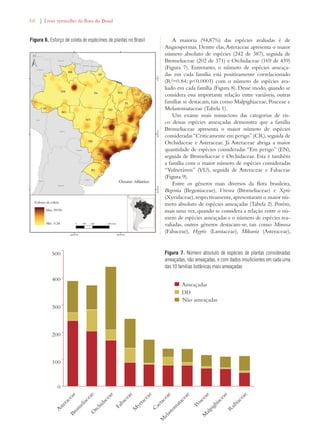




![82 | Livro vermelho da flora do Brasil
Pantanal: a fragilidade da biodiversidade
sob as águas
O Pantanal é uma planície de inundação periódica de
cerca de 140.000 km² (Pott; Pott, 2004) de grande beleza
devido a sua biodiversidade. Circundados por áreas mais
elevadas de planaltos, correm os rios que alimentam a
planície alagada (MMA/Ibama, 2010), e são os locais
que mais sofrem com a perda de hábitat, principalmente
para a agricultura e a pecuária. A mineração, apesar de
não ser comum atualmente, contaminou com mercúrio
os rios da região e causou erosão do solo (Mittermeier et
al., 1990). O turismo não sustentado torna-se predatório
e afeta toda a rede trófica do bioma devido à caça e
pesca ilegais (Alho; Sabino, 2011).
A pecuária é a atividade econômica mais impor-tante
e antiga no Pantanal (Mittermeier et al., 1990).
Atualmente há cerca de 3,5 milhões de cabeças de gado,
que utilizam basicamente pastagem com espécies nati-vas
(Pott; Pott, 2004) e exóticas que acabam por invadir
outras áreas, excluindo competitivamente espécies nati-vas.
A implementação de hidrovias, hidrelétricas e outras
obras vem se tornando a principal ameaça ao bioma
nas últimas décadas (Alho; Sabino, 2011; MMA/Ibama,
2010).
Referências
Alho, C. J. R.; Sabino, J. 2011. A Conservation Agenda for the
Pantanal’s Biodiversity. Brazilian Journal of Biology 71(1):327-
335.
Mittermeier, R. A.; Câmara, I. de G.; Pádua, M. T. J.; Blanck, J.
1990. Conservation in the Pantanal of Brazil. Oryx 24(2):103-
112,.
MMA/Ibama. 2012. Monitoramento do desmatamento nos biomas
brasileiros por satélite - acordo de cooperaçao técnica MMA/Ibama -
Monitoramento do Bioma Pantanal 2002-2008. Brasília: MMA/
Ibama.
Pott, A.; Pott, V. J. 2004. Features and Conservation of the
Brazilian Pantanal Wetland. Wetlands Ecology and Management
12(6):547-552.
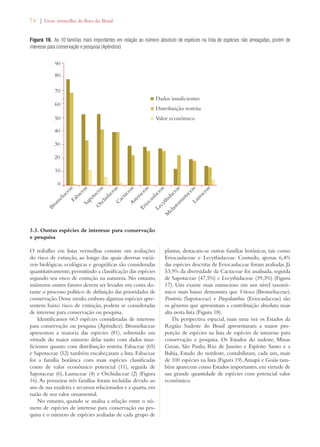
No alto: Pantanal em estado primitivo de conservação, Serra do
Amolar (MS) (Foto: Eduardo Fernandez)
No centro: Hidrelétricas ameaçam a diversidade do Pantanal (Foto:
Ecologia e Ação [www.ecoa.org.br])
À direita: Mapa dos remanescentes do bioma Pantanal](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-83-320.jpg)









![102 | Livro vermelho da flora do Brasil
Referências/References
Abensperg-Traun, M. 2009. CITES, Sustainable Use of Wild
Species and Incentive-driven Conservation in Developing
Countries, with an Emphasis on Southern Africa. Biological
Conservation (142)5:948-963
Forzza, R.C.; Leitman, P.M.; Costa, A.F.; Carvalho Jr., A.A.;
Peixoto, A.L.; Walter, B.M.T.; Bicudo, C.; Zappi, D.; Costa,
D.P.; Lleras, E.; Martinelli, G.; Lima, H.C.; Prado, J.; Stehmann,
J.R.; Baumgratz, J.F.A.; Pirani, J.R.; Sylvestre, L.; Maia, L.C.;
Lohmann, L.G.; Queiroz, L.P.; Silveira, M.; Coelho, M.N.;
Mamede, M.C.; Bastos, M.N.C.; Morim, M.P.; Barbosa, M.R.;
Menezes, M.; Hopkins, M.; Secco, R.; Cavalcanti, T.B.; Souza
V.C. 2010. Introdução. In: Catálogo de Plantas e Fungos do
Brasil. Rio de Janeiro: Jardim Botânico do Rio de Janeiro.
IUCN. 2001. IUCN Red List Categories. Version 3.1. Gland-
Cambridge: IUCN Species Survival Commission, World
Conservation Union.
Miranda, H.S.; Sato, M.N.; Neto, W.N Aires, F.S. 2009.
Fire in the Cerrado, the Brazilian Savanna. In: Cochrane, M.A.
(org.). Tropical Fire Ecology – Climate Change, Land Use and
Ecosystem Dynamics. Berlim/Berlin-Heidelberg: Springer, p.
427-450.
Myers, N.; Mittermeier, R.A.; Mittermeier, C.G.; da
Fonseca, A.B. Kent, J. 2000. Biodiversity Hotspots for
Conservation Priorities. Nature 403:853-858.
Raimondo, D.; von Staden, L.; Foden, W.; Victor, J.E.;
Helme, N.A.; Turner, R.C.; Kamundi, D.A. P.A. Manyama.
2009. Red List of South African Plants. Strelitzia 25. Pretoria:
South African National Biodiversity Institute.
Scarano, F.R. Martinelli, G. 2010. Brazilian List of
Threatened Plant Species: Reconciling Scientific Uncertainty
and Political Decision-making. Natureza Conservação 8:13-18.
Sobral, M. Stehmann, J.R. 2009. An Analysis of New
Angiosperm Species Discoveries in Brazil (1990-2006). Taxon
58(1):227-232.
Souza, V.C. 2010. Introdução: as gimnospermas do Brasil.
In: Forzza, R.C., et al. (org.). Catálogo de plantas e fungos do Brasil
[online]. Rio de Janeiro: Andrea Jakobsson Estúdio, Instituto de
Pesquisas Jardim Botânico do Rio de Janeiro, vol.1, p. 75-77.
Abaixo: Parque Estadual da Serra do Aracá (AM)
Na página à direita: Dickia reitzii, em Aparados da Serra
(Fotos: Ricardo Azoury)](https://image.slidesharecdn.com/livrovermelho-141024095545-conversion-gate01/85/Livro-vermelho-103-320.jpg)