Configuración Electrónica (QM04 - PDV 2013)
- 2. LOS NÚMEROS CUÁNTICOS: DESCRIPCIONES DEL ELECTRÓN Como consecuencia del principio de indeterminación (Heisenberg) se deduce que no podemos dar una descripción de la posición y movimiento de los electrones en el lenguaje de la física clásica. Existe una física nueva, llamada “mecánica cuántica” que entrega una representación más satisfactoria de las partículas con masa despreciable. Los electrones de un átomo poseen propiedades energéticas distintas, razón por la cual, siempre son distinguibles. En otras palabras, todos los electrones de un átomo son distintos a pesar de su masa y carga iguales. La situación energética de cada uno está definida por cuatro estados cuánticos. A cada estado cuántico le corresponde un número, de modo que hay 4 números asociados a cada electrón. Estos números identifican y describen la situación energética de cada electrón que orbita. NÚMEROS n, , m y s n: número cuántico principal Determina el nivel energético de la región que ocupa el electrón. Cuanto mayor sea n, mayor es la energía de la nube electrónica. Cabe hacer notar que el movimiento de los electrones en estos niveles no es uniforme y la forma circular es sólo ilustrativa de éstas divisiones. Sus valores van desde el 1 en adelante, según el nivel donde se encuentre el electrón (originalmente se designó con letras). 2
- 3. : número cuántico secundario o azimutal Determina la forma de la nube electrónica. Físicamente corresponde a la zona más probable donde encontrar al electrón. Toma valores asociados a n, que van desde 0 (cero) hasta n-1. A cada letra le corresponde un número, por lo tanto Si n=1 entonces Si n=2 entonces Si n=3 = 0 = 0 y 1 = 0, 1 y 2 entonces Orbital s: ( = 0) Orbitales p: ( = 1) Orbitales d: ( = 2) Orbitales f: ( = 3) Si sólo utilizáramos los números cuánticos principal (n) y azimutal (), nos quedaría una tabla como la siguiente (de difícil lectura) n 1 2 3 4 0 021 03132 0414243 Al reemplazar los valores de = 0, 1, 2, 3; por las letras s,p,d,f respectivamente se obtiene la siguiente secuencia ordenada de orbitales y electrones por nivel 1 2 3 4 s s2p s3p3d s 4 p 4 d4 f 3
- 4. m: número cuántico magnético Determina la orientación espacial de la nube electrónica en respuesta al campo magnético ejercido por el núcleo atómico. Éste número magnético depende del azimutal y toma valores desde - hasta + pasando por cero. Si = 0, entonces m=0 (Un valor del número cuántico magnético, una orientación) Si = 1, entonces m=-1, 0, +1 (3 valores para el número cuántico magnético, corresponden tres orientaciones). Si = 2, entonces m=-2,-1,0,+1,+2 (Cinco valores del número cuántico magnético, cinco orientaciones) 4
- 5. Si = 3, entonces m=-3,-2,-1,0,+1,+2,+3 (Siete valores del número cuántico magnético, siete orientaciones) s: número cuántico de Spin El estudio de los electrones revela la existencia de tres campos magnéticos distintos, el primero está asociado al movimiento del electrón en torno del núcleo y los otros dos son interpretados como movimientos de rotación del electrón respecto a su propio eje. Si el electrón fuese considerado como una esfera, tendría dos sentidos de rotación: horario y antihorario. Se acostumbra a asociar a esos dos sentidos de rotación (que en realidad son los dos campos magnéticos anteriormente referidos) dos números, cuyos valores son +½ ó -½. 5
- 6. VALORES PERMITIDOS PARA LOS NÚMEROS CUÁNTICOS Capa n m Número de electrones distribuidos TOTAL K 1 0(s) 0 2 2 L 2 0(s) 1(p) 0 -1,0,+1 2 6 8 M 3 0(s) 1(p) 2(d) 0 -1,0,+1 -2,-1,0,+1,+2 2 6 10 4 0(s) 1(p) 2(d) 3(f) 0 -1,0,+1 -2,-1,0,+1,+2 -3,-2,-1,0,+1,+2,+3 2 6 10 14 N 6 18 32
- 7. PRINCIPIO DE CONSTRUCCIÓN (AUFBAU) MÍNIMA ENERGÍA Todos los electrones que forman parte de un átomo adoptan los 4 números cuánticos que les permiten tener la menor energía posible. Puede afirmarse que, por regla general, los números cuánticos más bajos describen electrones de menor energía que los números cuánticos altos. Así el electrón con menor energía será aquel que tenga los siguientes números cuánticos: n = 1 = 0 m = 0 s = +½ CONVENIO Se asigna +½ al spin del primer electrón en un átomo. El orden en que son ocupados los orbitales puede encontrarse empleando una regla empírica sencilla, ésta es, que los electrones entran generalmente en aquel orbital que tenga el valor mínimo posible para la suma (n +). Así, el orbital 4s (con n = 4 y = 0; 4+0 = 4) se llena antes que el 3d (con n = 3 y = 2; 3+2 =5). En caso que resultara igual la suma en ambos casos, se llenará primero el que tenga el valor más bajo de “n”. Ejemplo: 3d 4p 3 + 2 = 5 4 + 1 = 5 Se llena primero el orbital 3 d (ya que n es menor). CONFIGURACIÓN ESTABLECIDA 7
- 8. EXCLUSIÓN DE PAULI “No pueden existir en un mismo átomo 2 o más electrones con sus cuatro números cuánticos iguales”. Sí pueden existir 2 electrones con tres números cuánticos iguales pero el cuarto debe ser distinto. Por cada orbital existen sólo 2 electrones en movimiento. Por consiguiente, de este principio se deduce el máximo de electrones por cada tipo de orbital. Los electrones se distribuyen de a pares: 2 en 1 orbital llamado s 6 en 3 orbitales llamados p (px, py y pz) 10 en 5 orbitales llamados d (dxy, dxz, dyz, dx2 -y2 y dz2 ) Las capacidades máximas de cada orbital son: ORBITAL s p d f VALOR DE 0 1 2 3 Nº MÁXIMO DE ELECTRONES 2 6 10 14 8
- 9. MÁXIMA MULTIPLICIDAD DE HUND Cuando los electrones penetran en un nivel de valores dados de “n” y “”, los valores de “s” mantienen el mismo signo, o sea, igual spin (llamado spin paralelo) hasta que se haya semicompletado la capacidad, sólo entonces se inicia el apareamiento. Dicho de otro modo, sólo cuando se haya semicompletado un nivel de energía con los electrones, la regla de Hund permite el apareamiento y por tanto y por tanto completar el nivel electrónico. Por ejemplo, aplicando el principio de Hund para la configuración np4, sería INCORRECTO CORRECTO 9
- 10. LA CONFIGURACIÓN ELECTRÓNICA El llenado de los niveles energéticos con electrones considerando el principio de construcción se conoce como “CONFIGURACIÓN ELECTRÓNICA”. Para el llenado con electrones debemos considerar los dos primeros números cuánticos, n y , el resto es seguir la lógica planteada por el principio de Aufbau. El diagrama de Pauling es una ayuda para la asignación, así por ejemplo: Capas R Q P O N M L K Niveles 8 7 6 5 4 3 2 1 Máximo nº e por nivel 8s 7s 6s 5s 4s 3s 2s 1s 7p 6p 5p 4p 3p 2p 6d 5d 4d 3d 2 8 18 32 32 18 8 2 5f 4f El orden de llenado de los orbitales sigue un orden específico que se resume en un esquema denominado diagrama de de moeller. Por ejemplo, un átomo con 8 electrones (Z = 8), tiene una configuración electrónica 1s 2 2s2 2p4, los números cuánticos correspondientes se obtienen al analizar al último electrón de la configuración; 4 2p l=1 n=2 px py pz -1 0 +1 1 electrón p 4 2 electrones 3 electrones 4 electrones m = -1 10 s = -1/2
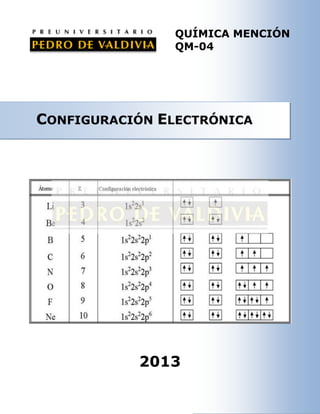
- 11. La siguiente tabla muestra las configuraciones electrónicas de los 30 primeros elementos del sistema periódico: 1 H 1 s1 2 He 1 s2 3 Li 1 s2 , 2 s1 4 Be 1 s2 , 2 s2 5 B 1 s2 , 2 s2 2 p1 6 C 1 s2 , 2 s2 2 p2 2 7 N 1 s , 2 s 2 p3 8 O 1 s2 , 2 s2 2 p4 9 F 1 s2 , 2 s2 2 p5 2 2 10 Ne 1 s , 2 s 2 p6 11 Na 1 s2 , 2 s2 2 p6 , 3 s1 12 Mg 1 s2 , 2 s2 2 p6, 3 s2 2 2 13 Al 2 1 s , 2 s 2 p , 3 s2 3 p1 14 Si 1 s2 , 2 s2 2 p6 , 3 s2 3 p2 15 P 1 s2 , 2 s2 2 p6 , 3 s2 3 p3 2 2 6 6 2 3 p4 3 p5 16 S 1 s , 2 s 2 p , 3 s 17 Cl 1 s2 , 2 s2 2 p6 , 3 s2 2 2 6 2 3 p6 18 Ar 1 s , 2 s 2 p , 3 s 19 K 1 s2 , 2 s2 2 p6 , 3 s2 3 p6 , 4 s1 20 Ca 1 s2 , 2 s2 2 p6 , 3 s2 3 p6 , 4 s2 2 2 6 2 6 3 p , 4 s2 3 d1 21 Sc 1 s , 2 s 2 p , 3 s 22 Ti 1 s2 , 2 s2 2 p6 , 3 s2 3 p6 , 4 s2 3 d2 23 V 1 s2 , 2 s2 2 p6 , 3 s2 3 p6 , 4 s2 3 d3 2 2 6 2 6 3 p , 4 s 1 3 d5-- * 24 Cr 1 s , 2 s 2 p , 3 s 25 Mn 1 s2 , 2 s2 2 p6 , 3 s2 3 p6 , 4 s2 3 d5 26 Fe 1 s2 , 2 s2 2 p6 , 3 s2 3 p6 , 4 s2 3 d6 2 2 6 2 6 3 p , 4 s2 3 d7 27 Co 1 s , 2 s 2 p , 3 s 28 Ni 1 s2 , 2 s2 2 p6 , 3 s2 3 p6 , 4 s2 3 d8 29 Cu 1 s2 , 2 s2 2 p6 , 3 s2 3 p6 , 4 s1 30 Zn 2 2 1 s , 2 s 6 2 p , 3 s 2 6 3 p , 4 s 2 3 d10-- * 3 d10 Los asteriscos que aparecen en los elementos Cr y Cu, señalan que sucede una pequeña irregularidad en favor de la estabilidad del elemento; el orbital d “le quita” un electrón al orbital “s” para semicompletar y completar los orbitales “d”. Se produce entonces una promoción electrónica desde un orbital s a un orbital d. DMTR-QM04 Puedes complementar los contenidos de esta guía visitando nuestra Web http://www.pedrodevaldivia.cl/ 11
