Aminoacidos
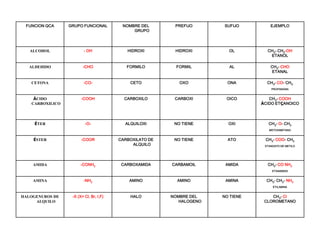
- 1. FUNCION QCA GRUPO FUNCIONAL NOMBRE DEL GRUPO PREFIJO SUFIJO EJEMPLO ALCOHOL - OH HIDROXI HIDROXI OL CH3- CH2-OH ETANOL ALDEHIDO -CHO FORMILO FORMIL AL CH3- CHO ETANAL CETONA -CO- CETO OXO ONA CH3- CO- CH3 PROPANONA ÁCIDO CARBOXILICO -COOH CARBOXILO CARBOXI OICO CH3- COOH ÁCIDO ETÇANOICO ÉTER -O- ALQUILOXI NO TIENE OXI CH3- O- CH3 METOXIMETANO ÉSTER -COOR CARBOXILATO DE ALQUILO NO TIENE ATO CH3- COO- CH3 ETANOATO DE METILO AMIDA -CONH2 CARBOXAMIDA CARBAMOIL AMIDA CH3- CO NH2 ETANAMIDA AMINA -NH2 AMINO AMINO AMINA CH3- CH2- NH2 ETILAMINA HALOGENUROS DE ALQUILO -X (X= Cl, Br, I,F) HALO NOMBRE DEL HALOGENO NO TIENE CH3- Cl CLOROMETANO
- 3. • Es cualquier molecular orgánica que posee por lo menos un grupo carboxilo (un acido orgánico) y un grupo amino (una base orgánica). • Forman a las proteínas. • Existen 20 aminoácidos estándar que forman las proteínas de la mayoría de los organismos. Aminoácidos
- 4. • Algunos microorganismo evolucionaron para usar 22 aminoácidos (selenocisteína y la pirrolisina). • La selenocisteína puede considerarse el aminoácido 21, aunque solo se ha encontradoen algunas enzimas codificadas por Escherichia coli (formato deshidrogenada).
- 5. Fórmula general • Carbono α, es un carbono quiral por lo tanto hay enantiomeros (isomeros ópticos).
- 6. Estructura de una proteína Los aminoácidos están unidos mediante "enlaces amida" denominados enlaces peptídicos. Las propiedades físicas y químicas de las proteínas se determinan a partir de los aminoácidos que las forman.
- 7. Configuración: • Hay dos tipos: • d: dextrarotatorio • L:levorotatorio • Rotan la luz polarizada a la derecha y a la izquierda respectivamente.
- 8. • La mayoria de los aminoacidos con actividad biológica son los del tipo “l” (forman parte de las proteínas). • Existen algunos casos de aa del tipo “d” con actividad biológica, los cuales se han encontrado en vertebrados superiores, invertebrados y bacterias. Figura: Imágenes especulares de la alanina
- 10. Clasificación • Aminoácidos con cadenas laterales no polares: Alanina, valina, leucina, isoleucina, prolina, fenilalanina, metionina y tripftofano. • Aminoácidos con cadenas polares polares con carga en el pH fisiológico. Glicina, serina, cisteína, treonina, tirosina, asparagina y glutamina • Aminoácidos con cadena lateral acida. Ácido aspártico y acido glutámico • Aminoácidos con cadenas laterales básicas. Histidina, lisisna y arginina.
- 13. Las proteínas disueltas en solución acuosa en su estructura terciaria ocultan en su interior la parte hidrofobica de estas.
- 14. Aminoácidos esenciales • Aminoácidos que el organismo no puede sintetizar y lo tenemos que ingerir en la dieta. Esto quiere decir que nuestro organismo puede sintetizar varios aminoácidos a partir de lo que ingerimos.
- 15. Aminoácidos esenciales Aminoácidos no esenciales Histidina Alanina Leucina Arginina Isoleucina Asparagina Lisina Acido Aspartico Metionina Cisteína Fenilalanina Glutamina Treonina Acido glutámico Triptofano Glicina Valina Prolina Serina Tirosina Aminoácidos esenciales en el ser humano
- 16. • El numero de aminoácidos escenciales puede variar de organismo a organismo. • Ejemplo: Escherichia coli (es una bacteria) no tiene ningún aminoácidos esencial (o sea que el puede sintetizar los 20 aminoácidos) a partir de lo que toma del ambiente): los seres humanos requerimos de 9 aminoácidos esenciales.
- 17. • Es un endulcolorante formado por la unión de dos aminoácidos (Acido aspartico y fenilalanina) unidos por enlace peptídico. Es 200 veces mas dulce que el azúcar de caña (sacarosa). Los dos aminoácidos que forman el aspartame se encuentran de manera natural en muchos alimentos como las frutas y verduras. Aspartame
- 18. • Este tipo de edulcolorantes se usa en una gran variedad de productos dietéticas (refrescos, polvos para preparar bebidas, yogurts, chicles, etc). No se ha demostrado algún efecto nocivo sobe la salud.
- 19. La configuración (S) de los aminoácidos. Casi todos los aminoácidos naturales tienen configuración (S), con estereoquímica parecida a la del L-(-)-gliceraldehído, por lo que se denominan L-aminoácidos. Excepto la glicina, todos los α aminoácidos son quirales. El centro quiral es el átomo de carbono asimétrico α.
- 20. Aminoácidos estándar. Hay veinte α-aminoácidos, denominados aminoácidos estándar, que prácticamente se encuentran en todas las proteínas.
- 21. Aminoácidos estándar. Los aminoácidos estándar difieren unos de o tros en la estructura de las cadenas laterales enlazadas a los átomos de carbono α.
- 22. Formación zwitterión. A pesar de que generalmente los aminoácidos se escriben con un grupo carboxílico (-COOH) y un grupo amino (-NH2), su estructura real es iónica y depende del pH. El grupo carboxílico pierde un protón, dando lugar a un ión carboxilato, y el grupo amino se protona y da lugar a un ión amonio. A esta estructura se le denomina ión dipolar o zwitterión.
- 23. Curva de valoración de la glicina El pH controla la carga de la glicina: catiónica por debajo de pH = 2.3; aniónica por encima de pH = 9.6 y zwitteriónica entre pH = 2.3 y 9.6. El pH isoeléctrico es 6.0. El punto isoeléctrico es el pH al que el aminoácido se encuentra en equilibrio entre las dos formas, como el zwitterión dipolar con una carga neta de cero.
- 24. Síntesis de Gabriel y malónica. Uno de los mejores métodos para sintetizar aminoácidos consiste en combinar la síntesis de Gabriel de aminas con la síntesis malónica de ácidos carboxílicos. El éster N-ftalimidomalónico se alquila de la misma forma que el éster malónico. La hidrólisis y la descarboxilación da lugar a un α-aminoácido racémico.
- 25. Síntesis de Strecker de alanina. Mediante la síntesis de Strecker se puede obtener una gran variedad de aminoácidos a partir de aldehídos apropiados. El mecanismo es similar al de la formación de una cianohidrina, excepto en que en la síntesis de Strecker el ión cianuro ataca a la imina en lugar de al aldehído.
- 26. Mecanismo de la síntesis de Strecker. Primero, el aldehído reacciona con amoniaco para formar una imina. La imina es un análogo nitrogenado del grupo carbonilo y es electrofílica cuando se protona. El ataque del ión cianuro a la imina protonada da lugar a α-aminonitrilo. En un paso separado, la hidrólisis del α-aminonitrilo da lugar a un α-aminoácido
- 27. Enzima acilasa. Una enzima acilasa (como la acilasa del riñón de cerdo o la carboxipeptidasa) sólo desacila al aminoácido natural L La mezcla resultante de D-aminoácido y de L-aminoácidos desacilados se separa fácilmente
- 28. Reacción de un aminoácido con ninhidrina. La ninhidrina es un reactivo común para visualizar las manchas o bandas de los aminoácidos que se han separado por cromatografía o electroforesis. La ninhidrina produce el mismo colorante púrpura, independientemente de la estructura del aminoácido original. La cadena lateral del aminoácido se pierde en forma de aldehído. La ninhidrina se puede utilizar en la detección de huellas dactilares dado que existen trazas de aminoácidos en las secreciones de la piel
- 29. Estabilización por resonancia. la estabilización por resonancia de una amida da lugar a su gran estabilidad, a la disminución de basicidad del átomo de nitrógeno y a la rotación restringida (carácter de doble enlace parcial) del enlace C-N. En un péptido, el enlace amida se denomina enlace peptídico. Tiene seis átomos en un plano: el C y el O del carbionilo, el N y su H, y los dos átomos de carbono asociados.
- 30. Uniones disulfuro. La cistina, dímero de la cisteína, se obtiene cuando dos residuos de cisteína se oxidan y forman un puente disulfuro. La oxidación suave enlaza dos moléculas de un tiol para formar un puente disulfuro.
- 31. Oxidación de una cistina a ácido cisteico La oxidación de una proteína mediante la ruptura de todas las uniones disulfuro por el ácido peroxifórmico, oxidando la cisteína a ácido cisteico. Los puentes de cisteína, cuando se reducen a la forma tiol, tienen tendencia a reoxidarse y volver a formar puentes disulfuro.
- 32. Cada grupo carbonilo peptídico se une mediante un enlace de hidrógeno a un hidrógeno del grupo N-H de la siguiente vuelta de la hélice. Las cadenas laterales se simbolizan por esferas verdes en el modelo molecular de la figura
- 33. Reordenamiento de lámina plegada. Cada grupo carbonilo peptídico está unido mediante enlace de hidrógeno al hidrógeno del grupo N-H de una cadena peptídica adyacente. Este ordenamiento puede hacer que se alineen muchas moléculas de péptidos unas al lado de las otras, dando lugar a una lámina bidimensional.
- 34. Estructura terciaria de las proteínas globulares. En la estructura terciaria de una proteína globular típica se mezclan segmentos de hélice α con segmentos de enrollamiento al azar en los puntos donde se dobla la hélice.
- 35. Estructuras de una proteína La estructura primaria es la estructura enlazada covalentemente, incluyendo la secuencia de aminoácidos y los puentes disulfuro. La estructura secundaria incluye las áreas de hélices α, láminas plegadas o enrollamientos al azar. En la estructura terciaria se incluye la conformación total de la molécula. En la estructura cuaternaria se incluye la asociación de dos o más cadenas peptídicas de la proteína activa.
- 36. LAS PROTEINAS *
- 37. La relación estructura-función a nivel de proteínas. ●Constitución de las proteínas. ●Estructuras primaria, secundaria, terciaria y cuaternaria. ●Fuerzas que determinan y estabilizan la estructura tridimensional de las proteínas. *
- 38. IMPORTANCIA DE LAS PROTEÍNAS *
- 39. LOS AMINOÁCIDOS SON LOS PRINCIPALES CONSTITUYENTES DE LAS PROTEÍNAS. Deacuerdo a su composición se les denomina: ●Péptido: A la unión de un bajo número de aminoácidos. ●Oligopéptido: Si el número de aminoácidos que forma la molécula no es mayor de 10. ●Polipéptido: Cuando es superior a 10. ●Proteína: Si el número es superior a 50 aminoácidos. *
- 40. *
- 41. Dependiendo de la necesidad del cuerpo Esenciales ●Valina (Val) ●Leucina (Leu) ●Treonina (Thr) ●Lisina (Lys) ●Triptófano (Trp) ●Histidina (His) ●Fenilalanina (Phe) ●Isoleucina (Ile) ●Metionina (Met) No esenciales ●Alanina (Ala) ●Prolina (Pro) ●Glicina (Gly) ●Serina (Ser) ●Cisteína (Cys) ●Asparagina (Asn) ●Glutamina (Gln) ●Tirosina (Tyr) ●Ácido aspártico (Asp) ●Ácido glutámico (Glu) ●Tirosina (Tyr) *
- 42. PROPIEDADES DE LOS AMINOÁCIDOS *
- 43. ISOMERÍA DE LOS ALFA-AMINOÁCIDOS *
- 44. ENLACE DE LAS PROTEÍNAS *
- 45. Estructuras primaria, secundaria, terciaria y cuaternaria de las proteínas. *
- 46. ●Estructura primaria: es la secuencia de aminoácidos de la proteína. Nos indica qué aminoácidos componen la cadena polipeptídica y el orden en que dichos aminoácidos se encuentran. La función de una proteína depende de su secuencia y de la forma que ésta adopte. *
- 47. *
- 48. ●Estructura secundaria: organización en el espacio de la cadena polipeptídica estabilizada por puentes de hidrógeno entre los elementos C=O y NH de los enlaces peptídicos. *
- 49. Estructuras secundarias Estructura en alfa hélice ●Hay 3.6 aminoácidos por cada vuelta, y cada vuelta tiene 5.4 ángstrom. Esta estructura fue propuesta por Linus Pauling en 1951. Hoja plegada o estructura beta. ●En esta disposición los aminoácidos no forman una hélice sino una cadena en forma de zigzag, denominada disposición en lámina plegada. *
- 50. *
- 51. ●Estructura terciaria: se refiere a los plegamientos que tienen la cadena proteica, por encima de la estructura secundaria, que determinan la forma tridimensional total de la proteína. ●Estos plegamientos se originan por interacciones particulares entre los grupos R de los aminoácidos que los forman, por ejemplo el puente disulfuro que se origina por interacción entre los azufres de los grupos R de la cisteína, o los puentes de hidrógeno. *
- 52. *
- 53. ●Estructura cuaternaria: solo la tienen las proteínas formadas por varias cadenas polipeptídicas con estructura terciaria, unidas mediante enlaces débiles (no covalentes), para formar un complejo proteico. Cada cadena polipeptídica recibe el nombre de protómero. *
- 54. FUERZAS DE ATRACCIÓN EN LAS PROTEÍNAS. Tipo de enlace Fuerza (kcal/mol) Covalente -50 a –100 Iónico o salino -1 a –80 Puentes de Hidrógeno -3 a –6 Van der Waals -0,5 a –1 Hidrofóbico -0,5 a –3 *
- 55. *
- 56. EN RESÚMEN ●Las proteínas son biopolímeros (llamados polipéptidos) de L-amino ácidos. ●Los aminoácidos en las proteínas se unen entre sí mediante enlaces peptídicos. ●Solo los L-aminoácidos se utilizan para hacer proteínas (salvo raras excepciones de las proteínas de la pared celular de las bacterias que contienen D-aminoácidos. ●El orden o secuencia de aminoácidos de las proteínas las distingue unas de otras. ●La secuencia de aminoácidos determina la forma tridimensional de la proteína. ●Alteraciones de la secuencia de aminoácidos de una proteína cambia su forma tridimensional. ●La diferencia entre los términos polipéptido y proteína es que el primero hace referencia a una cadena de aminoácidos. Por otra parte, una proteína es una cadena de aminoácidos después de su plegamiento y otras modificaciones. Las proteínas pueden consistir en mas de una cadena de polipéptidos. ●Las proteínas tienen una gran cantidad de funciones en el cuerpo, como son la de catalizar reacciones, proporcionar integridad estructural, participar en el transporte de moléculas, facilitar el movimiento, la unión de moléculas y otras. *
- 57. *
- 58. DESNATURALIZACIÓN DE LAS PROTEÍNAS GLOBULARES Determinados cambios ambientales producen la desnaturalización ó desplegado de la proteína, con pérdida de sus propiedades específicas. FACTORES QUE INFLUYEN: • Calentamiento por encima de su temperatura de desnaturalización térmica • pH fuertemente ácido ó básico • Presencia de alcohol ó urea RENATURALIZACIÓN: Restaurando las condiciones fisiológicas se revierte el proceso
- 59. DESNATURALIZACIÓN DE LAS PROTEÍNAS Consiste en la pérdida de todas las estructuras de orden superior (secundaria, terciaria y cuaternaria) quedando la proteína reducida a un polímero estadís Consecuencias inmediatas son: - Disminución drástica de la solubilidad de la proteína, acompañada frecuentemente de precipitación - Pérdida de todas sus funciones biológicas - Alteración de sus propiedades hidrodinámica
- 60. Temperatura (uu.arbitrarias) 0 2 4 6 8 10 12 Viscosidadintrínseca,[] 0 1 LA DESNATURALIZACIÓN ES UN PROCESO COOPERATIVO
- 61. DESNATURALIZACIÓN TÉRMICA DE LA RIBONUCLEASA “Bioquímica” Stryer, Berg y Tymoczko Ed. Reverté, S.A. 2003 Desnaturalización Renaturalización Molécula nativa Molécula desnaturalizada
- 63. DINÁMICA DE LAS PROTEÍNAS GLOBULARES Las proteínas globulares son estructuras dinámicas, sufren movimientos que se han agrupado en tres clases: 1. Vibraciones y oscilaciones de átomos ó grupos 2. Movimientos concertados de elementos estructurales (hélices, por ej.) 3. Movimientos de dominios completos, apertura y cierre de hendiduras. Los dos últimos son bastante más lentos y están implicados en las funciones catalíticas de las enzimas.