Analise alcanos
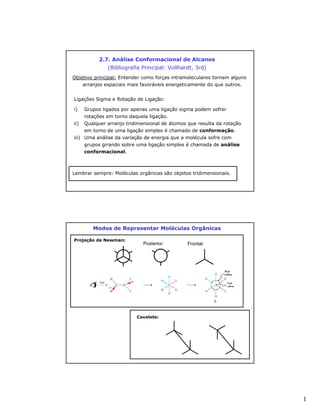
- 1. 2.7. Análise Conformacional de Alcanos (Bibliografia Principal: Vollhardt, 3rd) Objetivo principal: Entender como forças intramoleculares tornam alguns arranjos espaciais mais favoráveis energeticamente do que outros. Ligações Sigma e Rotação de Ligação: i) Grupos ligados por apenas uma ligação sigma podem sofrer rotações em torno daquela ligação. ii) Qualquer arranjo tridimensional de átomos que resulta da rotação em torno de uma ligação simples é chamado de conformação. iii) Uma análise da variação de energia que a molécula sofre com grupos girando sobre uma ligação simples é chamada de análise conformacional. Lembrar sempre: Moléculas orgânicas são objetos tridimensionais. Modos de Representar Moléculas Orgânicas Projeção de Newman: Posterior: Frontal: Cavalete: 1
- 2. Modos de Representar Moléculas Orgânicas De acordo com o ângulo diedro, os grupos podem ser classificados em Eclipsados, Gauche e Anti. Eclipsados: Gauche: Anti: 2.7.1. Análise Conformacional do Etano i) Conformação mais estável é a conformação alternada. Ocorre a máxima separação possível dos pares de elétrons das seis ligações C-H. ii) Conformação menos estável é a conformação eclipsada. Requer a interação repulsiva máxima entre os elétrons das seis ligações C-H. Alternada Eclipsada Alternada Lembrar que: maior energia → menor estabilidade 2
- 3. Análise Conformacional do Etano Projeção de Newman: Cavalete: Eclipsada Eclipsada Alternada Alternada Análise Conformacional do Etano Diferença de energia entre as duas conformações do etano: 3 Kcal/mol (12 KJ/mol). Esta diferença de energia é chamada de energia torsional. Na temperatura ambiente: 100 da conformação alternada pra 1 da eclipsada. 3
- 4. 2.7.2. Análise Conformacional do Butano Comparação entre conformações gauche e anti: Análise Conformacional do Butano Temperatura de 25 °C: 72% anti e 28% gauche. Importante: As barreiras de rotação na molécula do butano e do etano são pequenas demais para permitir o isolamento dos confôrmeros em temperaturas próximas ao ambiente. Podemos considerar que a rotação das ligações é livre. 4
- 5. 2.7.3. Análise Conformacional de Outros Alcanos 2.7.4. Estabilidade Relativa dos Cicloalcanos: Tensão de Anel Os cicloalcanos diferem em suas estabilidades relativas. O cicloalcano mais estável é o cicloexano. Calor de Combustão O calor de combustão de um composto é a variação de entalpia na oxidação completa do composto, ou seja, a energia liberada. Incremento regular de 157,4 Kcal mol-1 por cada grupo CH2 adicional. Assim, para cicloalcanos (cuja fórmula geral é (CH2)n esperaríamos que ∆H° = - (n X 157,4) Kcal mol-1 5
- 6. Calor de Combustão dos Cicloalcanos Origem da Tensão de Anel no Ciclopropano Ciclopropano “aberto”: Tensão Torsional: Ciclopropano: Razões da tensão de anel do ciclopropano: i) Tensão angular: Energia necessária para distorcer os carbonos tetraédricos de modo a permitir a sobreposição dos orbitais. Notar que não é possível uma sobreposição dos orbitais sp3 dos átomos de carbono de maneira tão eficiente quanto em outros alcanos. ii) Tensão torsional: hidrogênios eclipsados. 6
- 7. Origem da Tensão de Anel no Ciclobutano Ciclobutano possui tensão de anel como o ciclopropano. No ciclobutano, a distorção da planaridade diminui a tensão torsional com relação ao ciclopentano. Tensão angular também é menor do que no ciclopropano. 2.7.5. Análise Conformacional do Ciclopentano A tensão de anel no ciclopentano é menor do que no ciclopropano e no ciclobutano. No ciclopentano, a conformação mais estável é a envelope. A conformação tipo envelope diminui a tensão torsional. A planaridade iria introduzir considerável tensão torsional, pois todos os 10 átomos de hidrogênio estariam eclipsados. 7
- 8. 2.7.6. Análise Conformacional do Cicloexano: Conformações Possíveis Conformação tipo cadeira: não tem tensão angular e torsional. Arranjo alternado dos substituintes na conformação cadeira: Análise Conformacional do Cicloexano: Conformações Possíveis Conformação tipo barco: i) não tem tensão angular, mas tem tensão torsional. ii) Tem energia mais elevada do que a conformação cadeira. 8
- 9. Análise Conformacional do Cicloexano: Conformações Possíveis Conformação barco torcido é mais estável do que a barco, já que a tensão torsional é menor. Análise Conformacional do Cicloexano Como a conformação cadeira é mais estável do que as outras, mais de 99% das moléculas estão em um dado instante na conformação cadeira. 9
- 10. Análise Conformacional do Cicloexano: Átomos de Hidrogênio Axial e Equatorial No cicloexano observamos dois tipos de hidrogênio: a) 6 ligações C-H axiais b) 6 ligações C-H equatoriais Análise Conformacional do Cicloexano: Átomos de Hidrogênio Axial e Equatorial Quando passamos de cadeira para outra, todas as ligações que eram axiais se tornam equatoriais e vice-versa. Temperatura ambiente: 100.000 conversões por segundo! 10
- 11. Análise Conformacional do Cicloexano: Como Desenhar um Cicloexano 1 2 3 4 Análise Conformacional do Cicloexano: Conformações do Metilcicloexano: Interação 1,3-Diaxial A conformação com o grupo metila em equatorial é cerca de 1,7 Kcal/mol mais estável do que aquela com a metila em axial. Na temperatura ambiente, 95% das moléculas do metilcicloexano estão na conformação com a metila em equatorial. 11
- 12. Análise Conformacional do Cicloexano: Conformações do Metilcicloexano A tensão causada pela interação 1,3-diaxial no metilcicloexano é similar àquela causada pela proximidade dos átomos de hidrogênio dos grupos metila na forma gauche do butano. Análise Conformacional do Cicloexano: Conformações do t-Butilcicloexano A conformação do t-butilcicloexano com o grupo t-butila equatorial é 5 kcal/mol mais estável do que conformação com o grupo axial. Na temperatura ambiente, 99,99% das moléculas possuem o grupo t- butila na posição equatorial. 12
- 13. 2.7.7. Cicloalcanos Dissubstituídos: Isomerismo cis/trans Substituintes do mesmo lado do anel: cis. Substituintes em lados opostos: trans Exemplos: As propriedades físicas destes isômeros são diferentes. cis- e trans-1,2-Dimetilciclopentanos são estereoisômeros. São diastereoisômeros! 2.7.8. Análise Conformacional de Cicloalcanos Dissubstituídos Exemplo 1: trans-1,4-Dimetilcicloexano: 99% das moléculas em diequatorial. Diferença de energia: 3,4 Kcal/mol. Exemplo 2: cis-1,4-Dimetilcicloexano: As duas conformações tipo cadeira são equivalentes. 13
- 14. Análise Conformacional de Cicloalcanos Dissubstituídos Quando um grupo alquila é maior do que o outro, a conformação mais estável será aquela em que o grupo mais volumoso encontra-se na posição equatorial. Exemplo: trans-1-t-butil-3-metilcicloexano H H 14
