Anti viraux et immunomodulateurs.ppt
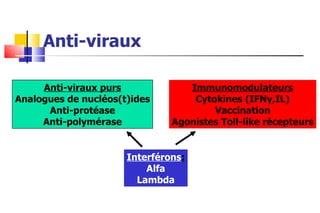
- 1. Anti-viraux Anti-viraux purs Analogues de nucléos(t)ides Anti-protéase Anti-polymérase Immunomodulateurs Cytokines (IFN γ ,IL) Vaccination Agonistes Toll-like récepteurs Interférons : Alfa Lambda
- 6. INTERFERON Récepteur / (IFNAR) IFN IFN IFN + IFNAR2 IFNAR1 Intermédiaire IFNAR1 = 110 -130 Kd IFNAR2 = 55 - 95 Kd
- 7. INTERFERON Mécanisme d’action P STAT-1 P P STAT ISRE 48 P STAT-1 STAT-1 STAT-2 STAT-2 Tyk-2 Jak-1 IFN Tyk-2 et Jak-1 =Tyrosines kinases STAT S = facteurs de transcription ISRE = Interferon Sensitive Response Element
- 11. VOIE DE LA 2 ’5 ’ OAS 2 ’5 ’ OAS inactive 2 ’5’ OAS activée (plasmique ou nucléaire) pppA (2 ’pA) n ppp(A) + pA 2 ’ phosphodiestérase pA (2 ’pA) n phosphatase Endonucléase active Endonucléase inactive Dégradation des ARN S pA (2 ’ pA) n = 2 ’ - 5 ’ oligonucléotides
- 12. PKRi PKRa ARN double brin ATP Mg++ Mn++ P P P el F2i el F2a transcription IFN + ACTIVATION DE LA PKR
- 13. IFN ISDR NS5A PKR PKR P Ribosome elF-2 Réplication virale Réplication virale traduction Synthèse protéique ARN cellule hôte elF-2
- 14. INTERFERON ALPHA Effet immunomodulateur IFN IFN IFN IFN HLA II Th0 Th2 Activation Cellule B Prolifération Anticorps IFN Activation IL12 rIL12 Th1 CTL NK HLA I
- 17. Les nouveaux interférons Interféron Laboratoire Phase Commentaires Albinterféron Novartis 3 S2:non; S4: en cours Oméga-IFN Intarcia Th 2a O-IFN+RBV:36% IFNa2b-XL Scherring/ Flamel 2a =Pega2b Infergen-XL Flamel 1 Locteron Biolex Th 2a Lambda-IFN Zymogenetics/BMS 3 Effets II Efficacité ≠
- 18. IFN and Type 1 IFNs ISGF: Interferon-Stimulated Genes Factor IRF: Interferon Regulatory Factor ISRE: Interferon Stimulated Response Element ISG: Interferon-Stimulated Genes
- 20. ADN VHB sous IFN-PEG a2a et séroconversion HBe EASL 2006 – T. Piratvisuth, abstract 49 2,30 log 10 cp/ml Séroconversion HBe et HBs à S72 (n = 8) -3,8 log 10 cp/ml -5,84 log 10 cp/ml 10 000 cp/ml Pas de séroconversion HBe à S72 (n = 184) Séroconversion HBe à S72 (n = 87) 12 10 8 6 4 2 0 ADN VHB moyen (log 10 cp/ml ) 0 12 24 36 48 60 72 Semaines Traitement Suivi 33 % 29 % 38 % Période de Survenue séroconversion HBe
- 23. INITIATION Entécavir 3 ’ AAA 5 ’ A A T G
- 24. TRANSLOCATION et ELONGATION Lamivudine Emtricitabine Entécavir 3 ’ AAA POL 5 ’ AATG DR1 Adéfovir Ténofovir
- 25. Réduction de l’ADN du VHB après 1 an de Traitement ADV 1 10 mg ADV 2 30 mg LAM 3 LdT 3 ETV 4 TDF 5 -3,5 -4,8 -5,5 -6,5 -6,9 -6,4 *Données issues d’études indépendantes, ne permettant pas de comparaisons (populations différentes, valeurs initiales de charges virales et méthodes de quantifications de l’ADN du VHB différentes) Patients AgHBe-positifs 1 Hepsera [RCP]; 2 Marcellin et al., N Engl J Med 2003, 348: 808-16; 3 Sebivio [RCP]; 4 Baraclude [RCP]. 5 Heathcote et al., AASLD 2007, abstract LB6; Fontana R.J., Gastroenterlogy 2009, 136(2):389-92. Réduction de l’ADN du VHB à 1 an (Log 10 )
- 27. I388S F501L V508L L515M V515M T519S A535V M539I M539V V542I L564V S588T LAMIVUDINE DOMAINE B DOMAIN C 832 RNaseH RT TP spacer Y63 1 a.a. 421 600 YMDD A B C D E Allen, Hepatology 98; Bartholomeusz, J. Hepatol 97; Pichoud, Hepatology 99
- 28. MUTANTS YMDD Lai C et al. N Engl J Med 1998;339:61-8. Leung NWY et al. J Hepatology 1999;30:59A Chang T et al. Antiviral therapy 2000;5:44A. Années de Lamivudine
- 30. ADN VHB LAM-RESISTANTS -3.6* 0.0 -4.0* *p<0.001 compared to LAM. LAM ADV 10 mg + LAM ADV 10 mg
- 31. SITES DE MUTATION DE LA POLYMERASE Terminal Protein Spacer Reverse Transcriptase RNase H F G A C D E B 1 344 YMDD M204V or I A181V or T Observed in ADV-treated patients N236T K241E K318Q Lamivudine resistance mutations V173L L180M
- 32. INCIDENCE DES MUTATIONS a.Locarnini et al. J Hepatol 2005; 42 (suppl. 2) : 17 b.Lai et al Clinical Infectious Diseases (2003) 36:687 ADV (N236T/A181V) étude 438 a LAM (M204V/I) b 0% 24% 3% 42% 11% 53% 70% Incidence de la Resistance 18% 29%
- 34. ENTECAVIR :ADN VHB Mean log HBV DNA (MEq/mL) Dosing Weeks
- 37. TOLERANCE Rash Tenofovir Adefovir Lamivudine Telbivudine Entecavir Amylase, lipase Peripheral neuropathy Myalgia, rhabdomyolyse CPK Pancreatite Nécrose tubulaire Cl Créatinine Hypophosphatemie Acidose lactique Thrombocytopenie Dyspnée Malaise Céphalées Gastrointestinal Vertige Très fréquent: 1/10 Rare: 1/1,000-1/10,000 fréquent: 1/100-1/1,000 Très rare: >1/10,000 Expert Panel Italian Guidelines STI review 2009;2:14-27 .
- 38. Résistance à 6 ans LVD 1 ETV * 5,6 LdT †2, 3 ADV ‡ 1 TDF § 4 § Patients avec ADN VHB ≥400 copies/mL à S72 peuvent ajouter FTC au TDF; ainsi la résistanceau TDF monotherapie après 72 semaines ne peut pas être totallement certifiée 5,6 * probabilité cumulée d’apparition de résistance; † AgHBe (+) naïf; ‡ AgHBe(-) Naïf; N/A non disponible Année 3 1.2% 0% 55% 11% Année 4 1.2% – 0% 71% 18% Année 2 <1% 0% § 46% 3% 25% Année 1 <1% 0% 23% 0% 5% Année 5 – – 80% 29% 1.2% Année 6 – – – – 72 SEMAINES 1. Locarnini S. Hepatol Int . 2008;2:147-51. 2. Lai CL, et al. N Engl J Med, 2007;357:2576-8; 3. Liaw YF, et al. Gastroenterology 2009;136:486-95. 4. Snow-Lampart A, et al. AASLD Oct 31–Nov 4, 2008, San Francisco, USA. Oral Presentation 977 Hepatology 2008;48:745A. 5. Baraclude EU SmPC, February 2009. 6. Tenney et al. EASL April 22–26, 2009, Copenhagen, Denmark, Oral Presentation 1761. – 1.2%
- 39. MUTATIONS DE RESISTANCE 845 a.a. Terminal protein spacer Pol/RT RNaseH A B C E D 1 183 349 692 YMDD V173L L180M M204I/V GVGLSPFLLA I(G) II(F) (rt1) (rt 344) LAM / FTC ETV T184G S202I M250V ADV A181V N236T LdT M204I Allen Hepatology 1998, Delaney J Virol 2003, Angus Gastroenterology 2003, Villeneuve J Hepatol 2003, Lai AASLD 2003, Colonno HepDart 2003
- 40. Choisir la bonne molécule antivirale: impact des données de résistance croisée *: (+ L180M + M204I/V). 1. Allen et al. Hepatology 1998;27:1670–7; 2. Gish et al. J Hepatol 2005;43:60–6; 3. Qi et al. J Hepatol 2004;40:20–1; 4. Tenney et al. AAC 2004;48:3498–507; 5. Lai et al. Gastroenterology 2005;129:528–36; 6. Sheldon et al. Antivir Ther 2005;10:727–34; 7. Delaney et al. AAC 2006 ; 8. Schildgen et al NEJM 2006; Borroto-Esoda et al EASL 2007 S= Sensitive R= Resistant I= Intermediate 0000 Lamivudine 1 Telbivudine 5 Entecavir 4 Adefovir 3 Tenofovir 6 Wild-type S S S S S M204l R R R S S L180M + M204V R R I S S A181 T/V I S S R S N236T S S S R I I169T + V173L + M250V* R R R S S T184G + S202lI/G * R R R S S
- 42. Cinétique de l‘ARN VHC Hours x 10 6 copies/mL Lam et al., Hepatology. 1997;26:226-231
- 43. ARN VHC Effet de la Pégylation 0 2 4 6 8 10 12 0 24 48 IFN TIW IFN + RBV PEG IFN Daily IFN Temps
- 46. MECANISME D’ACTION DE LA RIBAVIRINE Glutamine PRA IMP (Inosine monophosphate) XMP (Acide xanthylique) GMP, GDP, GTP Ribavirine Ribavirine - MP
- 48. Cinétique virale: Apport de la ribavirine Feld et al, Gastroenterology 2010
- 50. Un déficit génétique protégeant de l’anémie Permet de détecter ≈ 30% des patients présentant un risque négligeable de développer une anémie Aide à la décision clinique chez les patients à haut risque d’anémie
- 52. ANALOGUES DE LA RIBAVIRINE Viramidine Lévovirine Ribavirine O N O H H O H O N N H 2 N NH.HCl N N N H 2 N O O H O O H O H O N O H H O H O N N H 2 N O
- 53. Taribavirine
- 54. TARIBAVIRINE ARN VHC<39UI/ml Anémie:<10g/dl Poordard et al, Hepatology 2010
- 55. Cibles Thérapeutiques NS3 Site de fixation du substrat de la protéase Site catalytique de la protéase Site de fixation du zinc Site de fixation du substrat de la protéase NS2/NS3 Site d’attachement à la membrane de la protéase-hélicase Site de fixation du substrat de la protéase Site de fixation de NS4A Pawlotsky JM, Chevaliez S, McHutchison JG, Gastroenterology 2007
- 56. Les inhibiteurs de protéase NS3 Pré-clinique Phase I Phase II Phase III Nom Classe thérapeutique Telaprevir (Vx-950) (Janssen,Tibotec) Inhibiteur protéase NS3/4 Boceprevir (SCH503034) (Schering Plough) Inhibiteur protéase NS3/4 TMC 435350 (Tibotec Medivir) Inhibiteur protéase NS3/4 ITMN-191 R7227 (Intermune, Roche) Inhibiteur protéase NS3/4 BI 201335 (Boehringer) Inhibiteur protéase NS3/4 MK 7009 (Merck) Inhibiteur protéase NS3/4 SCH 900518 (Schering Plough) Inhibiteur protéase NS3 GS-9256 (Gilead) Inhibiteur protéase NS3
- 57. Les inhibiteurs de protéase NS3 Pré-clinique Phase I Phase II Phase III Nom Classe thérapeutique AVL-181 (Avila) Inhibiteur protéase NS3 ACH-0141625 (Achillion) Inhibiteur protéase NS3/4 MK-5172 (Merck) Inhibiteur protéase NS3/4 BMS-650032 (BMS) Inhibiteur protéase NS3/4 AVL-192 (Avila) Inhibiteur protéase IDX-320 (Idenix) Inhibiteur protéase
- 58. HCV Protease Inhibiteur SCH 503034
- 59. SCH 503034 Monothérapie 14 Jours HCV-1 IFN NRs, Diminution de HCV-RNA Treatment Follow-up
- 62. VX-950 750 mg x 3/j Patients naïfs VHC-1 Jour 0 1 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 -7 -4 -3 -2 -1 Evolution de l’ARN VHC (médiane, Log 10 IU/mL) -5 -6 0.0 -7.0 -4.0 -3.0 -2.0 -1.0 -5.0 -6.0 Placebo * Reesink et al. DDW. 2005.
- 63. VX-950/Peg IFN -2a Patients naïfs VHC-1 0 1 2 3 4 5 6 7 8 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Jours HCV RNA (Log 10 IU/mL ) Reesink et al. EASL. 2006 ARN VHC < 30 UI/ml ARN VHC < 10 UI/ml Peg-IFN (n = 4) 0 0 VX-950 (n = 8) 1 1 VX-950/Peg-IFN (n = 8) 6 4
- 64. Alanine (A) Aspartate (D) Arginine (R) A156V/T Sauvage Telaprevir 155 156 168 RESISTANCE Inhibiteurs de protéase R155K/T Boceprevir Adapte de Kieffer et al. Hepatology. 2007;46(3):631-639. Graphic courtesy of Dr Ira M. Jacobson. 36 54 Valine (V) Threonine (T) V36A/M T54A T54A A156S/V D168A/V/E A156S/T 170 V170A ITMN-191 Valine (V)
- 66. Effets indésirables: Bocéprévir Kwo et al, Lancet 2010
- 68. Cibles Thérapeutiques RdRp (Pawlotsky JM, Chevaliez S, McHutchison JG, Gastroenterology 2007;132:1979-98) Site catalytique site NNI A site NNI B site NNI C site NNI D
- 71. R7128 (Pharmasset & Roche) Réduction de l’ARN du VHC -3.0 -2.0 -1.0 0.0 0 5 10 15 20 25 30 Jours Traitement Suivi -1,5 log 1500 mg /j - 2,1 log 750 mg x 2/j - 0,1 log Placebo -2,7 log 1500 mg x 2/j -0,9 log 750 mg /j Reddy et al, AASLD 2007)
- 72. R-7128 +PEG-IFN -2a plus RBV Mean change from baseline in plasma HCV RNA (log 10 IU/mL) Study day 0 5 10 15 20 25 30 -6 -5 -4 -3 -2 -1 0 Placebo R7128 500mg BID R7128 1500mg BID
- 74. HCV 796 (Wyeth) Efficacité antivirale ( Chandra et al, DDW 2006) - 1 2 5 8 1 1 1 4 1 7 2 0 2 3 2 6 2 9 - 3 - 2 - 1 0 1 P l a c e b o 5 0 m g 1 0 0 m g 2 5 0 m g 5 0 0 m g 1 0 0 0 m g 1 5 0 0 m g Jours Réduction ARN du VHC Traitement Suivi
- 75. GS-9190 (Gilead) -2.15 -2.00 -1.85 -1.70 -1.55 -1.40 -1.25 -1.10 -0.95 -0.80 -0.65 -0.50 -0.35 -0.20 -0.05 0.10 0 1 2 3 4 5 6 7 8 9 10 Jours) Réduction ARN du VHC Cohorte 1 (40mg) Cohorte 2 (120mg) Placebo Traitement -1,4 log 10 -1,7 log 10 (Jacobson et al., AASLD 2007)
- 76. Effet synergique des associations Effet synergique de l’association TMC-435 + 2 inhibiteurs NS5b dans le modèle du réplicon EASL 2010 – Lenz O., Belgique , abstract 759 actualisé Cellule contrôle TMC435 100 nM Tib-NI 25 µM Tib-NNI 1 µM TMC435 100 nM + Tib-NI 25 µM + Tib-NNI 1 µM 0 0,5 1,1 1,2 2,1 2,2 3,1 3,2 4,1 4,2 5,1 5,2 0 -0,5 -1,0 -1,5 -2,0 -2,5 -3,0 -3,5 -4,0 -4,5 0 colonie Semaines ARN VHC (log 10 ) dans le réplicon
- 77. INFORM-1 : première étude testant l’association d’une antiprotéase et d’un inhibiteur de l’ARN polymérase dans le VHC LID : limite inférieure de détection < 15 UI/ml Réponse virologique à J14 Non répondeurs complets NRC = réduction ARN VHC < 1 log 10 UI/ml à S4 ou < 2 log 10 UI/ml à S12 Diminution médiane de la charge virale Gane EJ.et all, Lancet 2010 59 Jours 0 3 5 7 9 11 13 1 2 3 4 6 7 Mediane log 10 ARN VHC (log UI/ml) 5 RG7227 + PEG-IFN + RBV RG7227/RG7128 (naïfs) RG7227/RG7128 (NRC) LID 1 RG7128 1000 mg x 2/j + RG7227 900 mg x 2/j 100 80 60 40 20 0 < 15 UI/ml < 43 UI/ml 25 63 50 88 % Naïfs Naïfs NRC NRC
- 78. INFORM 1 : association orale inhibiteur de protéase et inhibiteur de polymérase Réponse virologique Gane et al, Lancet 2010 0 20 40 60 80 100 Jour 13 Semaine 4 (n = 8) (n = 8) (n = 8) (n = 39) (n = 10) NR nuls NR non nuls Naïfs Naïfs poolés Placebo F E G BCDG Semaine 12 ARN-VHC indétectable (%) 25 13 38 13 38 75 0 20 60 100 88 63 53 80 33
- 79. Synergie des combinaisons GS-9256+GS9190 GS-9256: I protéase GS-9190: I polymérase Zeuzem et al, AASLD 2010
- 80. Synergie des combinaisons BI 201 335+ BI 207127 BI 201335:I Protéase BI 207127: I Polymérase Zeuzem et al, AASLD 2010 400mg: n=15 600mg: n=17 % PCR <25UI/l
- 81. BMS-790052 (inhibiteur de la NS5A) + BMS650032 (inhibiteur de protéase) chez les patients G1 répondeurs nuls AASLD 2010 – Lok A., Etats-Unis, Abstract LB8 actualisé Réponse virologique jusqu’à S12 Groupe A (sans P/R) Groupe B (avec P/R) 0 1 2 3 4 6 8 10 12 1 2 3 4 5 6 7 0 1 2 3 4 6 8 10 12 1 2 3 4 5 6 7 Semaines Semaines ARN VHC (log 10 ) ARN VHC (log 10 ) RV à S12 = 46 % RV à S12 = 90 %
- 83. Inhibiteurs de la cyclophiline Débio 025* *Interagit avec NS5b, sans propriétés anti-calcineurine Per os
- 84. Inhibiteurs de la cyclophiline Débio 025* Flisiak et al, Hepatology 2009
- 85. Agonistes des Toll-like récepteurs TLR Lympho B Cellules dendritiques + + + + IFN alfa IP-10 2’5’OAS
Notas do Editor
- L’étude de Lau a montré que chez les patients Ag HBe + un traitement par Pegasys permettait une séroconversion HBe chez 32 % des patients (87/271) et une séroconversion HBs chez 3 % des patients (8/271). Cette étude a pour but d’étudier la cinétique de l’ADN du VHB sous traitement en fonction de la réponse. Elle montre que cette séroconversion survient chez 33 % des patients dans les 24 premières semaines de traitement, chez 29 % entre la semaine 24 et 48 et chez 38 % des patients dans les 6 mois qui suivent l’arrêt du traitement. L’ADN du VHB baisse significativement plus rapidement et de façon plus importante chez les patients ayant une séroconversion HBe et HBs.
- Key message : entecavir has demonstrated potent viral load suppression across a range of baseline HBV DNA levels.
- L’ évolution de la virémie dans les 3 groupes ethniques est indiquée dans ces figures (médianes, et intervalle 25-75 %). Dans les 3 groupes ethniques, la charge virale diminue plus chez les homozygotes CC, moins et moins vite cependant chez les afro-américains. L’effet du génotype de l’IL28B et de l’ethnie sont indépendants.
- Slide 46: Chronic Hepatitis C: Side Effects of Ribavirin Ribavirin is associated with a distinct array of side effects, including: Hemolytic anemia Teratogenicity Cough and dyspnea Rash and pruritus Insomnia Anorexia However, combination therapy has been found to be consistent with the safety profile of each agent; no synergistic effects have been observed between the two agents. Rebetron package insert Maddrey WC. Sem Liver Dis 1999;19(Suppl 1):74.
- Genome wide analysis of patients from the IDEAL study identifies a causal role for ITPA genetic variation in ribavirin-induced hemolytic anemia A. Thompson1, J. Fellay2, D. Ge2, T. Urban2, K. Shianna2, M. Sulkowski3, A. Muir1, N. Afdhal4, I. Jacobson5, R. Esteban6, F. Poordad7, J. McCone8, M.L. Shiffman9, G. Galler10, W.M. Lee11, R. Reindollar12, J. King13, P. Kwo14, R. Ghalib15, B. Freilich16, L. Nyberg17, K. Patel1, H. Tillmann1, S. Noviello18, N. Bopari19, K. Koury18, L.D. Pedicone18, C. Brass18, J.K. Albrecht18, D. Goldstein2, J. McHutchison1. 1Duke Clinical Research Institute, Durham, NC 2Institute for Genome Sciences & Policy, Center for Human Genome Variation, Duke University, Durham, NC, 3Johns Hopkins University School of Medicine, Baltimore, MD, 4Beth Israel Deaconess Medical Centre, Boston, MA, 5Weill Cornell Medical College, New York, NY, 6Hospital General Universitario Valle de Hebron, Barcelona, Spain, 7Cedars-Sinai Medical Center, Los Angeles, CA, 8Mt. Vernon Endoscopy Center, Alexandria, VA, 9Virginia Commonwealth University, Richmond, VA, 10Kelsey Research Foundation, Houston, TX, 11University of Texas Southwestern Medical Center, Dallas, TX, 12Piedmont Healthcare, Statesville, NC, 13Louisiana State University, Shreveport, LA, 14Indiana University School of Medicine, Indianapolis, IN, 15The Liver Institute at Methodist Dallas Medical Center, Dallas, TX, 16Kansas City Gastroenterology and Hepatology, Kansas City, MO, 17Kaiser Permanente, San Diego, CA, 18Merck, Kenilworth, NJ, 19Former employee of Merck, Kenilworth, NJ Background/Aims: We performed a genome wide association study on a well characterized genotype 1 HCV treatment cohort to identify genetic determinants of ribavirin (RBV)-induced hemolytic anemia (HA). Methods: 1604/3070 patients treated with peginterferon (pegIFN) and RBV in the IDEAL study consented to DNA testing. Samples were genotyped using the Illumina Human610-quad BeadChip. After quality control, 97.5% of the single nucleotide polymorphisms (SNPs) included on the chip were used in the analyses. The primary analysis focused on the genetic determinants of quantitative change in hemoglobin (Hb) levels from baseline to week 4 of treatment (to minimize confounding by erythropoietin use), in 3 separate populations (Caucasians, African Americans, Hispanics) by logistic regression, adjusting for: age, gender, weight, liver fibrosis, baseline Hb level, RBV dose, and type/dose of pegIFN. A modified Eigenstrat method controlled for population stratification, and Bonferroni adjustment corrected for multiple testing. Results: 1,286 patients were included in the final analysis. The SNP rs6051702 on chromosome 20 was strongly associated with Hb reduction at week 4 in the 3 separate populations (overall P<10-46). Genotyping of known functional variants demonstrated that the association signal was entirely explained by SNPs in the adjacent ITPA gene (encoding inosine triphosphatase, ITPase): rs1127354 and rs7270101; the minor alleles cause ITPase deficiency and were protective against anemia. A composite ITPase deficiency allele showed an association of P=10-91. Predicted ITPase deficiency, defined according to functional studies of these variants, strongly protected patients against Hb falling >3g/dL by week 4 (P<0.0001) ( Figure 1 ). The causal ITPA variants were not associated with SVR. Conclusions: We have identified two functional variants in the ITPA gene that are strongly associated with the risk of RBV-induced HA. ITPA genotyping could help guide clinical decision-making, especially in patients at high risk for anemia or related morbidity.
- Une avancée significative est la découverte récente d’anti-protéases spécifiques du virus de l’hépatite C dont la protéine du laboratoire Schering appelée SCH 503034;
- Cette première étude portant chez les patients non répondeurs à l’interféron, a étudié différentes posologies de l’antiprotéase SCH 503034, pendant 14 jours. Comme on le voit il existe une diminution significative de la charge virale, > 1,5 log avec la posologie la plus élevée soit 400 mg 3 fois/jour pendant, donc, 14 jours.
- Chez le volontaire sain, à une posologie variant de 50 à 800 mg, on constate que la molécule est rapidement absorbée avec un T max de 1-2 H et un T 1/2 entre 7 et 15 H. La concentration maximum et l’aire sous la courbe sont augmentés en fonction de la dose.
- In this slide the individual curves of the 8 patients receiving VX-950 and Peg-IFN are depicted. All patients had continuous HCV-RNA decline during the 14 day study period. One subject in this group had a slower response than the rest of the group, still reaching a 3 log drop after a continual decline in viral load. Review of the demographic and pharmacokinetic factors for this patient do not demonstrate any clear reason for the slower response; Regardless, this patient started SOC after the completion of study dosing, and subsequently became HCV RNA undetectable, and remained undetectable at the most recent follow-up point.
- Les effets indésirables le plus souvent observés étaient, par ordre de fréquence, le prurit chez environ la moitié des patients sous télaprévir, les nausées, les rashs, l ’ an é mie et, chez environ un tiers des patients, la diarrh é e. Ces effets indésirables ont été responsables dans respectivement 7 %, 8 % et 4 % des cas d ’ arrêts pr é matur é s de traitement dans les groupes T12P/R, T8P/R et dans le groupe contrôle. Les rashs s é v è res é taient fr é quemment plus nombreux dans les groupes de patients recevant le t é lapr é vir (6 % et 3 %) que dans la groupe contrôle (1 %). Les rashs é taient r é versibles apr è s l ’ arrêt du traitement.
- En accord avec ces données, les analyses de modélisation ont suggéré que 12 semaines de télaprévir (TVR) pourraient être suffisantes pour obtenir la clairance du virus sauvage et des variants à faible niveau de résistance. Cependant, une petite population de ces variants pourrait persister après 8 semaines de traitement. Chez 91 patients ayant des données de séquençage disponibles et des variants résistants à TVR après échec du traitement, 55 (60 %) ne présentaient plus de mutations de résistance détectées à la fin de l ’é tude (suivi moyen 45 semaines). Le temps moyen pour la perte de d é tection des variants r é sistants é tait de 13, 24, 36 et 44 semaines pour T54, A156, V36 et R155. En résumé, les taux de RVS sous T8/P/R (69 %), T12/P/R (75 %) étaient significativement plus élevés que dans le bras contrôle. On constatait environ 5 % d ’é checs virologiques de plus dans le bras T8/P/R par rapport au bras T12/P/R, avec une pr é dominance de variants à faible niveau de r é sistance. De plus, la majorit é des patients n ’ avait plus de mutation de r é sistance à la fin de l ’é tude. Ces résultats suggèrent que le TVR continue à exercer une pression antivirale sur le virus sauvage et les variants à faible niveau de résistance entre S8 et S12, réduisant l ’é chec virologique ult é rieur pendant le traitement par P/R dans le bras T12P/R.
- Le TMC-435 est un inhibiteur de protéase NS3/4a, actuellement en phase II de développement avec une excellente activité antivirale. L’association de cette molécule avec deux inhibiteurs de la polymérase (un inhibiteur nucléosidique Tib-NI, et un inhibiteur non nucléosidique Tib-NNI) semble prometteuse en termes d’efficacité antivirale et d’absence de résistance croisée liée à des modes d’action différents. Cette étude dans le système réplicon confirme ces résultats en montrant un effet additif et synergique, une augmentation de la barrière de résistance et donc une meilleure activité antivirale. Ces résultats vont conduire à proposer des protocoles d’association dans un avenir proche.
- La cinétique de décroissance de la charge virale, sous bithérapie RG7128 et RG7227 est identique à celle observée avec la trithérapie RG7227 + PEG-IFN et ribavirine. Il n’y a pas de différence en termes de réduction de la charge virale entre les patients de génotype 1a (-4,8 log) ou 1b (-4,9 log) sur l’ensemble des 54 patients traités dans les différentes cohortes INFORM. Parmi les 74 patients traités par l’association RG7128 et RG7227, un patient a eu un rebond viral (1,4 log UI/ml) dans une cohorte faible dose (500 mg/12H R 7128 et 200 mg x 3/j de RG7227), aucune mutation de résistance n’a été identifiée. Le patient restait sensible à la RG7227 et la charge virale est devenue indétectable sous bithérapie. Par ailleurs, la cinétique de décroissance de la charge virale sous bithérapie RG7128 et RG7227 est identique à celle observée avec la trithérapie RG7227 + PEG-IFN et ribavirine. Aucun effet secondaire sérieux n’a été rapporté à ce jour. Parmi les effets secondaires observés dans les 3 cohortes, on note des céphalées chez 4/8 patients de la cohorte A, 3/8 et 1/8 patients des cohortes B et C, une dysgueusie chez 1 patient dans la cohorte A, des nausées chez 3/8 et 1/8 des patients des cohortes B et C, des diarrhées chez 2/8 patients de la cohorte B, une douleur thoracique non cardiaque chez un patient de la cohorte C et un rash chez un patient de la cohorte A et C. Aucune anomalie hématologique de grade 3 ou 4 n’a été rapportée. La tolérance est donc satisfaisante sur cette courte période de traitement. Les prochaines étapes vont étudier avec les doses biquotidiennes des cohortes B et C l’intérêt de l’association RG7128 et RG7227, seule ou associée, soit au Pegasys ® soit à la ribavirine soit, aux deux pendant un mois, chez des malades en échec thérapeutique.
- Cette étude de phase IIa, ouverte, randomisée a pour la première fois associé un inhibiteur de protéase BMS-650032 avec un inhibiteur de la région NS5A le BMS-790052, seul (groupe A) ou en association avec l’IFN-PEG α -2a et la ribavirine (groupe B) pendant 24 semaines. Dans le bras bithérapie, les patients présentant un rebond de la charge virale passaient en quadrithérapie. Après 12 semaines de traitement, 5/11 (46 %) du groupe A et 9/10 (90 %) du groupe B ont une CV indétectable (<10 UI/ml). 6 patients ont présenté un échappement sous traitement, des mutations de résistance dirigés à la fois contre les régions NS3 et NS5A ont été décrites. La tolérance des deux bras est correcte avec de façon surprenante pas de différence entre la bithérapie et la quadrithérapie. Ces résultats dans cette population difficile à traiter milite pour une quadrithérapie et révèle pour la première fois la possibilité d’apparition de mutations de résistance dirigée contre les deux molécules.