Hidrocarburos aromáticos: Características
- 1. HIDROCARBUROS AROMATICOS Mg. Q.F. LUIS MIGUEL FELIX VELIZ lumifeve@gmail.com 1
- 2. Descubierto por Faraday(1825) en el gas de alumbrado 1845: Hofmann lo aisla del alquitrán de hulla. En 1857 August Kekulé asentó las bases BENCENO: de la estructura orgánica diciendo que el representante de carbono era tetravalente y explicando los los compuestos ordenes de enlace y la capacidad que aromáticos, presenta el carbono de autoensamblarse. Aparecieron un montón de estructuras posibles para el benceno lumifeve@gmail.com 2
- 3. Dewar Ladenburg Benzvaleno Claus lumifeve@gmail.com 3
- 4. La fórmula estructurales propuestas más exitosa es la fórmula de Kekule. Pero no fue hasta 1865 que el propio Kekulé presentó la siguiente estructura basándose en sus trabajos. lumifeve@gmail.com 4
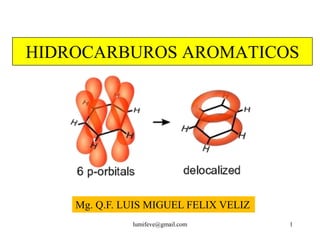
- 5. No fue hasta la década de 1930 que Linus Pauling en sus estudios de orbitales y análisis estructural pudo describir la forma y el comportamiento de los hidrocarburos aromáticos lumifeve@gmail.com 5
- 6. El benceno es un anillo plano de átomos de C con hibridación sp2 Todos los orbitales p no hibridados alineados. lumifeve@gmail.com 6
- 7. BENCENO: CARACTERISTICAS Todos los ángulos de enlace son de La longitud de todos los enlaces C-C 120º es de 1,397 Å . La conjugación y deslocalización de los e- en el benceno dan a este compuesto una estabilidad mayor que la de los ciclos no conjugados. lumifeve@gmail.com 7
- 8. CRITERIOS DE AROMATICIDAD Compuestos aromáticos son compuestos planares Todos los ángulos de enlace del benceno son iguales 120º, los de carbono e hidrógeno son iguales. Los enlaces en el benceno C-C es de 1,39 Aº. Sin embargo en los enlaces C-C- alifático es 1,54 Aº. C=C- alifático es 1,33 Aº. La energía de resonancia para los alquenos tiene un valor de aproximadamente 5 Kcal/mol, en el benceno es aproximadamente 36 Kcal/mol por lo que se considera que tiene bastante estabilidad. Dan reacciones de sustitución a diferencia de los alquenos que dan reacciones de adición. Posición de dobles enlaces esta en constante oscilación (resonancia) es decir no existe en el núcleo del benceno enlaces simples ni dobles, todos los enlaces son iguales. lumifeve@gmail.com 8
- 9. Además debe cumplir la regla de Hückel Para que un compuesto sea aromático el número de electrones pi en el sistema cíclico tiene que ser 4n+2, siendo n un número entero. Si el número de electrones pi en el sistema cíclico es 4n, siendo n un número entero, el compuesto es antiaromático. El benceno es un [6]anuleno con un anillo continuo de orbitales p que se solapan. En el benceno hay seis electrones pide modo que es un sistema 4n+2, con n=1. La regla de Hückelpredice que el benceno seráaromático. El ciclobutadieno es un [4]anuleno con un anillo continuo de orbitales p que se solapan pero tiene cuatro electrones pi. Como es un sistema 4n, con n=1, la regla de Hückel predice que el ciclobutadieno será antiaromático. lumifeve@gmail.com 9
- 10. Sera no Sera Aromático si es aromático si es 4n+2 4n 2π=0 4π=1 6π=1 8π=2 10π=2 12π=3 14π=3 16π=4 18π=4 Note que la regla de Hückel’s se refiere al número de electrones π , no al número de átomos en un anillo en particular. lumifeve@gmail.com 10
- 11. Nomenclatura de los derivados del benceno Se debe anteponer el nombre del grupo sustituyente a la palabra benceno. … benceno CI Br I NO2 Clorobenceno Bromobenceno Yodobenceno Nitrobenceno lumifeve@gmail.com 11
- 13. lumifeve@gmail.com 13
- 14. lumifeve@gmail.com 14
- 15. lumifeve@gmail.com 15
- 16. PROPIEDADES FÍSICAS En su mayoría son no polares e insolubles en agua, soluble en disolventes orgánicos no polares. Isómero “p” tiene un p.f. más alto que “o” y “m”. El aumento de “C” incrementa el punto de ebullición lumifeve@gmail.com 16
- 17. PROPIEDADES QUÍMICAS El benceno resiste la oxidación del KMnO4 y oxidantes similares En condiciones drásticas se oxida hasta anhídrido malico o hasta CO2 y H20 O O O O2/V 2O5 + CO2 + OH2 Las reacciones más características para los compuestos aromáticos es la reacción de sustitución electrofílica aromática (SEA), aunque también se conoce la reacción de sustitución nucleofílica aromática (SNA) lumifeve@gmail.com 17
- 18. Las reacciones al benceno y los otros compuestos aromáticos, son principalmente iónicas, en las que la aproximación de reactivos electrofílicos al núcleo favorece un desplazamiento electromérico. Lo cual propicia las reacciones de sustitución. lumifeve@gmail.com 18
- 19. REACCIONES DE SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA • Nitración: (NO2) • Sulfonación: (SO3) • Halogenación: (X) • Deutarización: (H-D) • Alquilación: (CH3) (Metalación) • Acilación: (R-C=O) (Azoicos) lumifeve@gmail.com 19
- 20. MECANISMO DE REACCIÓN El núcleo aromático posee electrones móviles, es un objeto favorable para los ataques electrofílicos. ETAPAS 1.- Formación del reactivo electrofílico: El proceso de sustitución lo precede la descomposición de las moléculas del reactivo XY, formándose una partícula electrofílica X y un anión Y XY X + + Y- lumifeve@gmail.com 20
- 21. MECANISMO DE REACCIÓN 2.-La partícula electrofílica interacciona con la nube electrónica del núcleo, formando un complejo , por el momento no está unido por un verdadero enlace químico. + + + X X lumifeve@gmail.com 21
- 22. MECANISMO DE REACCIÓN 3.- Posteriormente 2 e- de los 6 e- del ciclo se localizan en un átomo de carbono, participando en la formación del nuevo enlace - H - + + X X lumifeve@gmail.com 22
- 23. MECANISMO DE REACCIÓN 4.- Luego ocurre una rápida perdida del protón formando con el anión Y un producto lateral de la reacción. H X X HY + Y + lumifeve@gmail.com 23
- 24. REACCIONES DE MONOSUSTITUCIÓN A) HALOGENACIÓN: Presencia de catalizadores: AlCl3, AlBr3, FeCl3, FeBr3 Cl : Cl + AlCl3 Cl+ + [AlCl4] B) NITRACIÓN: catión nitronio NO2+ H2SO4 + HNO3 NO2++2HSO4- +H3O+ C) SULFONACIÓN: grupo sulfónico (-SO3H) se obtiene a partir de H2SO4 concentrado u oleum (fumante) H2SO4 SO3+ + HSO4- + H3O+ lumifeve@gmail.com 24
- 25. REACCIONES DE MONOSUSTITUCIÓN D) ALQUILACIÓN: (R- FRIEDEL-CRAFTS) introducción del grupo R+. Se parte de un haluro de alquilo (R-X) en presencia de un catalizador. CH3CH2Cl + AlCl3 CH3CH2+ + [AlCl4] E) ACILACIÓN: (R. FRIEDEL-CRAFTS) introducción de un grupo acilo. Se parte de un haluro de acilo en presencia de un catalizador. CH3COCl + AlCl3 CH3CO+ + [AlCl4] lumifeve@gmail.com 25
- 26. lumifeve@gmail.com 26
- 27. REACCIONES DE DISUSTITUCIÓN Se originan 3 tipos de isómeros, según la posición de cada uno de ellos se designa con los prefijos o de orto, m de meta, p de para. X X X X Y +Y + + + Y Y -o -m -p Para que predomine una de estas posiciones depende del primer sustituyente (X) tiene efecto orientador sobre el segundo sustituyente. lumifeve@gmail.com 27
- 28. Orientadores “o” y “p” (primer orden, activadores) -OH -NH2 A -OR C -O-C-CH T 3 I R V Cl I Br D I A D SH lumifeve@gmail.com 28
- 29. Orientadores “m”(segundo orden, desactivadores) -NO2 A -CN C -SO3 T -CHO I -COR V I -CO2H D CO2R A CONH2 D NH3 lumifeve@gmail.com 29
- 30. REACCIONES DE POLISUSTITUCIÓN Predomina el sustituyente de primer orden. Se debe tener en También cuenta: se debe Efecto observar sincrónico si hay: Hay Efecto impedimento antagónico estérico lumifeve@gmail.com 30
- 31. lumifeve@gmail.com 31