Mediastinal masses: anatomy and main causes
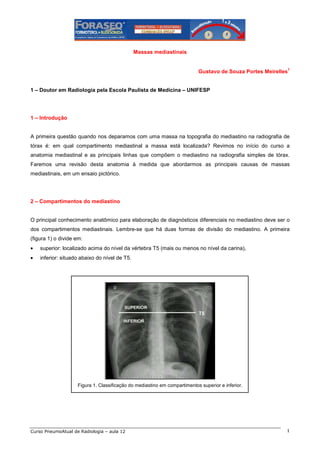
- 1. Massas mediastinais 1 Gustavo de Souza Portes Meirelles 1 – Doutor em Radiologia pela Escola Paulista de Medicina – UNIFESP 1 – Introdução A primeira questão quando nos deparamos com uma massa na topografia do mediastino na radiografia de tórax é: em qual compartimento mediastinal a massa está localizada? Revimos no início do curso a anatomia mediastinal e as principais linhas que compõem o mediastino na radiografia simples de tórax. Faremos uma revisão desta anatomia à medida que abordarmos as principais causas de massas mediastinais, em um ensaio pictórico. 2 – Compartimentos do mediastino O principal conhecimento anatômico para elaboração de diagnósticos diferenciais no mediastino deve ser o dos compartimentos mediastinais. Lembre-se que há duas formas de divisão do mediastino. A primeira (figura 1) o divide em: • superior: localizado acima do nível da vértebra T5 (mais ou menos no nível da carina), • inferior: situado abaixo do nível de T5. Figura 1. Classificação do mediastino em compartimentos superior e inferior. Curso PneumoAtual de Radiologia – aula 12 1
- 2. Outra classificação do mediastino, até mais comumente empregada, é a seguinte (figura 2): • anterior: borda posterior do esterno até a borda posterior do coração, • médio: borda posterior do coração até a borda anterior da coluna vertebral, • posterior: a partir da borda anterior da coluna vertebral. Figura 2. Divisão do mediastino em compartimentos anterior, médio e posterior Alguns autores preferem uma classificação diferente: • anterior: estende-se da borda posterior do esterno até a borda anterior do coração, • médio: borda anterior à borda posterior do coração, • posterior: a partir da borda posterior do coração. Fica a critério do leitor escolher qual classificação usar; isto não importa, desde que a divisão escolhida seja utilizada com consistência. Optaremos, neste curso, pela primeira classificação, ilustrada na figura 2. 3 – Mediastino anterior O mediastino anterior, pela classificação aqui utilizada, compreende todo o mediastino localizado anteriormente à borda posterior do coração. As principais lesões aqui encontradas são denominadas de os “3 Ts do mediastino anterior”: • Teratoma, • Timoma, • Terrível linfoma. Curso PneumoAtual de Radiologia – aula 12 2
- 3. Outras lesões do mediastino anterior são: • tumores de paratiróide, • hérnia de Morgagni, • tiróide ectópica, • cisto pericárdico, • mediastinite fibrosante, • lipomas, • aneurismas vasculares, • metástases linfonodais. • tumores cardíacos, A seguir ilustramos alguns exemplos das principais massas do mediastino anterior (figuras 3 a 6). Figura 3. Massa mediastinal anterior esquerda, apontada pelas setas, obliterando o espaço retroesternal. Este aspecto pode ser encontrado em teratomas ou linfomas. O diagnóstico neste caso foi de doença de Hodgkin. Curso PneumoAtual de Radiologia – aula 12 3
- 4. Figura 4. A radiografia de tórax em PA não demonstra alterações significativas, mas a radiografia em perfil evidencia massa na projeção do mediastino anterior (setas), com imagens densas internas compatíveis com calcificações. Timoma mediastinal anterior. Curso PneumoAtual de Radiologia – aula 12 4
- 5. Figura 5. Massa mediastinal anterior direita. A tomografia computadorizada confirmou o diagnóstico de teratoma. Caso gentilmente cedido pelo Dr. Jorge Kavakama (In memoriam). Curso PneumoAtual de Radiologia – aula 12 5
- 6. Figura 6. Outro caso de massa mediastinal anterior direita, confirmada como cisto pericárdico. 4 – Mediastino médio Pela classificação utilizada no curso, o mediastino médio compreende todo o mediastino da borda posterior do coração à margem anterior da coluna vertebral. As principais lesões aqui encontradas são: Curso PneumoAtual de Radiologia – aula 12 6
- 7. • tumores de esôfago, • aneurismas vasculares, • megaesôfago, • linfoma (figura 7), • cistos broncogênicos, • hérnia gástrica hiatal (figura 8). • tumores traqueais, • metástases linfonodais, • mediastinite fibrosante, Figura 7. Massa mediastinal média. Linfoma não-Hodgkin. Curso PneumoAtual de Radiologia – aula 12 7
- 8. Figura 8. Massa mediastinal média com nível hidro-aéreo, compatível com hérnia gástrica hiatal. 5 – Mediastino posterior Estende-se posteriormente a partir da margem anterior da coluna vertebral. As principais lesões aqui encontradas são as neoplasias de origem neural e os abscessos paravertebrais (figura 9). Curso PneumoAtual de Radiologia – aula 12 8
- 9. Figura 9. Massa mediastinal posterior direita (setas) em criança de cinco anos: ganglioneuroma. 6 – Leitura recomendada Felson B. Chest roentgenology. WB Saunders, Philadelphia, PA, 1973:574p. Juhl JH, Crummy AB, Kuhlman JE. Paul and Juhl's Essentials of Radiologic Imaging. Lippincott Williams & Wilkins, 1998, 1408p. McLoud TC. Thoracic Radiology: The Requisites. Mosby, 1998, 512p. Curso PneumoAtual de Radiologia – aula 12 9
- 10. Foraseq™ Fumarato de formoterol - Budesonida - Uso adulto e pediátrico (crianças a partir de 5 anos de idade) Forma farmacêutica e apresentações — Cápsula contendo pó seco para inalação: Tratamento 1: Cápsula contendo fumarato de formoterol micronizado para inalação de 12 mcg. Tratamento 2: Cápsula contendo budesonida para inalação, de 200 ou 400 mcg. Embalagens com 60 cápsulas de fumarato de formoterol + 60 cápsulas de budesonida e um inalador. Composição — Tratamento 1: Cada cápsula com pó para inalação contém: Fumarato de formoterol 12 mcg. Excipiente: Lactose. Tratamento 2: Cada cápsula com pó para inalação contém: 200 mcg ou 400 mcg de budesonida. Excipiente: Lactose. Informações ao paciente — Ação esperada do medicamento: FORASEQ contém cápsulas de formoterol, que tem ação broncodilatadora e cápsulas de budesonida que tem ação na redução da inflamação das vias aéreas dos pulmões. O uso seqüencial de um broncodilatador (com início de ação imediata) e um esteróide faz com que aumente a deposição deste nas vias aéreas e conseqüente melhora do controle da asma. Cuidados de armazenamento: FORASEQ deve ser protegido do calor (manter abaixo de 30°C) e da umidade. Prazo de validade: A data de validade está impressa no cartucho. Não utilizar o produto após a data de validade. Gravidez e lactação: Informe ao seu médico sobre a ocorrência de gravidez na vigência do tratamento ou após o seu término. O formoterol pode inibir o trabalho de parto, por seu efeito relaxante sobre a musculatura lisa do útero. Informe ao seu médico se está amamentando. Cuidados de administração: Antes de inalar o medicamento, leia atentamente estas instruções, pois elas contêm informações importantes sobre o produto. Em caso de dúvida, peça orientação ao seu médico. Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. As cápsulas só devem ser retiradas do blister imediatamente antes do uso. As cápsulas não podem ser ingeridas: elas devem ser utilizadas somente com o tipo de inalador fornecido na embalagem. Não utilize outro tipo de inalador. Se houver esquecimento de uma dose, aguarde para tomar a próxima no horário usual. A dose não deve ser dobrada. Como usar as cápsulas com o inalador: Atenção: Não engolir as cápsulas. Usar exclusivamente para inalação. Para assegurar uma administração adequada, o paciente deve ser informado sobre como usar adequadamente o inalador pelo médico ou por outro profissional de saúde. FORASEQ é utilizado no tratamento de doenças respiratórias, portanto a sua administração incorreta não produzirá o efeito desejado. Para usar o inalador, proceda do seguinte modo: 1. Retire a tampa do inalador. - 2. Segure firmemente a base do inalador e, para abri-lo, gire o bocal na direção indicada pela seta. - 3. Coloque a cápsula de formoterol no compartimento adequado, na base do inalador. É importante que a cápsula somente seja retirada do blister imediatamente antes do uso. - 4. Volte o bocal para a posição fechada. - 5. Pressione os botões laterais completamente só uma vez, mantendo o inalador em posição vertical. Solte os botões. Obs.: A cápsula pode partir-se em pequenos fragmentos de gelatina que podem atingir a sua boca ou a garganta. A gelatina é comestível e, portanto, não é prejudicial. Para minimizar a tendência de ocorrer isso, não perfure a cápsula mais de uma vez. Siga as instruções de armazenamento e não retire a cápsula do blister até o momento de usá-la. - 6. Expire o máximo possível. - 7. Coloque o bocal do inalador na boca e feche os lábios ao redor dele. Inspire, pela boca, de maneira rápida e o mais profundamente possível. Você deve ouvir um som de vibração, como se a cápsula girasse na câmara do inalador com a dispersão do produto. Se não ouvir esse ruído, a cápsula pode estar grudada em seu compartimento; se isso ocorrer, faça pequenos movimentos sobre o inalador a fim de desgrudar a cápsula do mesmo. Gire ou balance levemente o inalador (na posição vertical), a fim de desprender a cápsula. NÃO tente desprender a cápsula, apertando repetidamente os botões. 8. Quando ouvir o som de vibração, segure a respiração pelo maior tempo que você confortavelmente conseguir (aproximadamente 10 segundos); enquanto isso retire o inalador da boca. Em seguida, respire normalmente. Abra o inalador e verifique se ainda há resíduo de pó na cápsula. Se ainda restar pó na cápsula, repita os passos de 6 a 8. Obs.: Caso o seu médico tenha recomendado o uso de 2 cápsulas (24 mcg) de formoterol, repita os passos de 3 a 8. Nunca coloque duas cápsulas no inalador ao mesmo tempo. 9. Aguarde pelo menos 1 minuto. 10. Repita os passos de 3 a 8, agora utilizando 1 cápsula de budesonida. Obs.: Caso o seu médico tenha recomendado o uso de 2 cápsulas de budesonida, repita o passo 10. Nunca coloque 2 cápsulas no inalador ao mesmo tempo. 11. Após o uso, abra o inalador, remova a cápsula vazia, feche o bocal e recoloque a tampa. Limpeza do inalador: Para remoção do preparado, limpe o bocal e o compartimento da cápsula com um pano seco. Alternadamente, pode-se utilizar uma escova macia e limpa. Se o alívio na dificuldade de respiração não for adequado ou se perdurar por períodos menores do que o usual, informe ao seu médico o mais breve possível. Interrupção do tratamento: Não interromper o tratamento sem o conhecimento do seu médico. Reações adversas: Com FORASEQ, ocasionalmente podem ocorrer as seguintes reações: tremor, aceleração e irregularidade do batimento do coração ou dores de cabeça; raramente, ocorrem cãibras e dores musculares, agitação, tonturas, nervosismo ou cansaço, dificuldade para dormir, irritação na boca ou na garganta e broncoespasmo. Alguns desses efeitos desaparecem no decorrer do tratamento. Em alguns casos isolados, observaram-se reações alérgicas, com redução acentuada da pressão arterial e inchaço na face, pálpebras e lábios. Informe ao seu médico sobre o aparecimento de reações desagradáveis. Ingestão concomitante com outras substâncias: Informe ao seu médico sobre qualquer medicamento que esteja usando, antes do início ou durante o tratamento. Contra-indicações e precauções: O uso de FORASEQ é contra-indicado a pacientes com alergia à budesonida e/ou formoterol ou à lactose. A budesonida também é contra-indicada em pacientes com tuberculose pulmonar ativa. As cápsulas de pó para inalação de FORASEQ são adequadas para crianças a partir de 5 anos de idade, desde que estas possam usar o inalador corretamente, contando com a ajuda de um adulto (ver Como usar as cápsulas com o inalador). FORASEQ é também adequado para pacientes idosos. Informe ao seu médico caso você sofra de alguma doença do coração, de diabetes ou se tem problemas de tireóide. Todo medicamento deve ser mantido fora do alcance das crianças. Não tome remédio sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde. Informações técnicas Formoterol Farmacodinâmica — O formoterol é um potente estimulante seletivo beta -adrenérgico. Exerce efeito broncodilatador em pacientes com obstrução reversível das vias aéreas. O efeito inicia-se rapidamente (em 1 a 3 minutos), permanecendo ainda significativo 12 horas após a inalação. Com as doses terapêuticas, os efeitos cardiovasculares são pequenos e ocorrem apenas ocasionalmente. O formoterol inibe a liberação de histamina e dos leucotrienos do pulmão humano sensibilizado passivamente. Algumas propriedades antiinflamatórias, tais como inibição de edema e do acúmulo de células inflamatórias, têm sido observadas em experimentos com animais. No homem, tem-se demonstrado que formoterol é eficaz na prevenção do broncoespasmo induzido por alérgenos inalados, exercícios, ar frio, histamina ou metacolina. Farmacocinética — Absorção: Assim como relatado para outros fármacos inalados, é provável que cerca de 90% do formoterol administrado por um inalador sejam deglutidos e então absorvidos a partir do trato gastrintestinal. Isto significa que as características farmacocinéticas da formulação oral se aplicam em grande parte ao pó para inalação. As doses orais de até 300 mcg de fumarato de formoterol são rapidamente absorvidas no trato gastrintestinal. Os picos de concentração plasmática da substância inalterada são atingidos de 1/2 hora a 1 hora após a administração. A absorção de dose oral de 80 mcg é de 65% ou mais. A farmacocinética do formoterol demonstra-se linear na faixa de dosagem investigada, isto é, 20 a 300 mcg. A administração oral repetida de doses diárias de 40 a 160 mcg não leva a acúmulo significativo do fármaco. Após a inalação de doses terapêuticas, não é possível detectar o formoterol no plasma, pelos métodos analíticos correntes; entretanto, a análise das taxas de excreção urinária sugere que o formoterol seja rapidamente absorvido. A taxa de excreção máxima após administração de 12 a 96 mcg é atingida em 1 a 2 horas após a inalação. A excreção urinária cumulativa do formoterol, após administração do pó inalado (12 a 24 mcg) e duas formulações diferentes de aerossol (12-96 mcg), demonstrou que a proporção de formoterol disponível na circulação aumenta proporcionalmente à dose. Distribuição: A ligação do formoterol às proteínas plasmáticas é de 61%-64% (34% principalmente à albumina). Não há saturação dos sítios de ligação na faixa de concentração atingida com doses terapêuticas. Biotransformação: O formoterol é eliminado principalmente pelo metabolismo, sendo a glicuronização direta a principal via de biotransformação. A o-demetilação seguida de glicuronização é outra via. Eliminação: A eliminação do formoterol da circulação parece ser polifásica; a meia-vida aparente depende do intervalo de tempo considerado. Baseando-se nas concentrações no plasma ou no sangue até 6, 8 ou 12 horas após a administração oral, foi determinada uma meia-vida de eliminação de aproximadamente 2-3 horas. A partir das taxas de excreção urinária, entre 3 e 16 horas após administração, foi calculada uma meia-vida de cerca de 5 horas. O fármaco e seus metabólitos são completamente eliminados do organismo; aproximadamente 2/3 de uma dose oral aparecem na urina e 1/3 nas fezes. Após a inalação, cerca de 6%-9% da dose, em média, são excretados inalterados na urina. O clearance (depuração) renal do formoterol é de 150 ml/min. Budesonida Farmacodinâmica — A budesonida é um corticosteróide com ação tópica marcante, mas praticamente desprovido de ação sistêmica no ser humano. Quando utilizado como cápsulas para inalação por pacientes que se beneficiam da terapia com corticosteróide, pode ocasionar o controle da asma geralmente dentro de 10 dias após o início do tratamento. O uso regular da budesonida reduz a inflamação crônica das vias aéreas de pacientes asmáticos. Deste modo, budesonida melhora a função pulmonar e os sintomas da asma, reduz a hiper-reatividade brônquica e previne as exacerbações da asma. Farmacocinética — Absorção: A quantidade de budesonida depositada nos pulmões é rápida e completamente absorvida. O pico de concentração plasmática é atingido imediatamente após a administração. Após correção para a dose depositada na orofaringe, a biodisponibilidade absoluta é de 73%; porém, por via oral é de cerca de 10%. Distribuição: O volume de distribuição da budesonida é de cerca de 300 litros. Em experimentos com animais foram observadas altas concentrações no baço e nas glândulas linfáticas, no timo, no córtex da supra-renal, nos órgãos reprodutivos e nos brônquios. A budesonida atravessa a barreira placentária em camundongos. Não se sabe se passa para o leite materno. Metabolismo: A budesonida não é metabolizada no pulmão. Após a absorção, é metabolizada no fígado, originando vários metabólitos inativos, inclusive 6-beta-hidroxi-budesonida e 16-alfa-hidroxiprednisolona. O clearance (depuração) é de 84 litros/hora, com meia-vida plasmática curta de 2,8 horas. Excreção: Após a inalação, 32% da dose absorvida são recuperados na urina e 15%, nas fezes. Dados de segurança pré-clínicos — Formoterol: Mutagenicidade: Foram conduzidos testes de mutagenicidade cobrindo uma ampla faixa de parâmetros. Não foi encontrado efeito genotóxico em qualquer dos testes efetuados in vitro ou in vivo. Carcinogenicidade: Estudos de 2 anos em ratos e 2 camundongos não indicaram qualquer potencial carcinogênico. Camundongos machos tratados com níveis de dosagem bastante altos demonstraram uma incidência ligeiramente maior de tumor benigno de célula subcapsular adrenal, o que se considera reflexo de alteração no processo fisiológico de envelhecimento. Dois estudos em ratos, com diferentes faixas de dosagem, demonstraram um aumento de leiomiomas mesovarianos. Esses neoplasmas benignos são tipicamente associados, em tratamentos prolongados de ratos, com altas dosagens de fármacos beta -adrenérgicos. Um aumento na incidência de cistos ovarianos e células tumorais benignas da teca e da granulosa foi também observado; são conhecidos os efeitos dos beta-agonistas em ovário de ratas, sendo os mesmos específicos de roedores. Alguns outros tipos de tumores observados no primeiro estudo com altas dosagens estavam de acordo com a incidência do controle histórico da população e não foram observados no ensaio de doses menores. Nenhuma das incidências de tumores aumentou a uma extensão estatisticamente significativa nas doses mais baixas do segundo estudo, dose esta que levou a uma exposição sistêmica 10 vezes maior do que a esperada com a dosagem máxima recomendada de formoterol. Baseando-se nas conclusões dos estudos e na ausência de potencial mutagênico, conclui-se que o uso de formoterol em doses terapêuticas não apresenta risco carcinogênico. Toxicidade sobre a reprodução: Testes em animais não demonstraram potencial teratogênico. Após administração oral, o formoterol foi excretado no leite de ratas lactantes. Budesonida: Não foram estabelecidos. Indicações — Formoterol (tratamento 1): É indicado para profilaxia e tratamento das broncoconstrições em pacientes com doença obstrutiva reversível das vias aéreas, tais como asma brônquica e bronquite crônica, com ou sem enfisema. Profilaxia de broncoespasmo induzido por alérgenos inalados, ar frio ou exercício. Como o efeito broncodilatador de formoterol é ainda significativo 12 horas após a inalação, a terapia de manutenção de 2 vezes ao dia pode controlar, na maioria dos casos, a broncoconstrição associada a condições crônicas, tanto durante o dia como à noite. Budesonida (tratamento 2): É indicado para asma brônquica, para controle da inflamação das vias aéreas. Contra-indicações — Hipersensibilidade ao formoterol e/ou à budesonida ou a qualquer um dos componentes da formulação. Budesonida é também contra-indicado em pacientes com tuberculose pulmonar ativa Precauções e advertências — Formoterol: Condições concomitantes: Cuidado especial e supervisão, com ênfase particular nos limites de dosagem, são necessários em pacientes tratados com formoterol, quando coexistirem as seguintes condições: doença cardíaca isquêmica, arritmias cardíacas, especialmente bloqueio atrioventricular de terceiro grau, descompensação cardíaca grave, estenose subvalvular aórtica idiopática, cardiomiopatia obstrutiva hipertrófica, tireotoxicose, prolongamento suspeito ou conhecido do intervalo QT (QTc > 0,44 seg; ver Interações medicamentosas). Pelo efeito hiperglicêmico dos beta -estimulantes, recomenda-se controle adicional de glicose sangüínea em pacientes diabéticos. Hipopotassemia: Hipopotassemia potencialmente grave pode resultar da terapia com beta -agonistas. Recomenda-se cuidado especial em asma grave, já que esse efeito pode ser potencializado por hipoxia e tratamento concomitante (ver Interações medicamentosas). Recomenda-se que os níveis de potássio sérico sejam monitorizados em tais situações. Broncoespasmo paradoxal: Assim como em outras terapias por inalação, o potencial para broncoespasmo paradoxal deve ser considerado. Se isso ocorrer, o medicamento deve ser imediatamente descontinuado e substituído por terapia alternativa. Budesonida: Os pacientes devem ter conhecimento da natureza profilática do tratamento com budesonida e da necessidade de ser administrado regularmente, mesmo quando não estiverem apresentando sintomas. Budesonida não produz alívio do broncoespasmo agudo, nem é adequado para o tratamento primário do estado asmático ou de outros episódios agudos de asma. São necessários cuidados especiais em pacientes com tuberculose latente, infecções fúngicas e virais das vias aéreas. Deve-se ter cautela ao tratar pacientes com distúrbios pulmonares, como bronquiectasias e pneumoconiose, em vista da possibilidade de infecções fúngicas. Durante as exacerbações agudas da asma pode ser necessário um aumento na dose de budesonida ou tratamento complementar com corticosteróides orais por um curto período de tempo e/ou antibióticos, caso ocorra infecção. Pacientes nãodependentes de corticosteróides sistêmicos: Normalmente, obtém-se efeito terapêutico em 10 dias. Em pacientes com secreção brônquica excessiva, pode-se administrar inicialmente um esquema curto adicional com corticosteróide oral (cerca de 2 semanas). Pacientes dependentes de corticosteróides sistêmicos: A transição de corticosteróides orais para budesonida deve preferencialmente ocorrer em pacientes com asma estável. Uma dose alta de budesonida é dada em combinação com a dose de corticosteróide oral previamente utilizada pelo paciente por pelo menos 10 dias. Após esta fase, a dose de corticosteróide oral deve ser gradualmente reduzida (por exemplo, 2,5 mg de prednisolona ou equivalente cada mês) até a maior redução possível. O tratamento com corticosteróides sistêmicos ou com budesonida não deve ser suspenso abruptamente. Uma precaução especial deve ser observada durante os primeiros meses em que se está havendo a troca de corticosteróide oral para a budesonida, a fim de garantir que a reserva adrenocortical destes pacientes é adequada para contornar situações como trauma, cirurgias ou infecções graves, visto que estes pacientes podem desenvolver quadro agudo de insuficiência adrenal. A função adrenocortical deve ser monitorizada regularmente. Alguns pacientes necessitam uma dose extra de corticosteróides nessas circunstâncias; estes devem ser aconselhados a carregar um cartão com a descrição desta combinação. A substituição de corticosteróides sistêmicos por budesonida pode revelar alergias anteriormente suprimidas por corticosteróides sistêmicos, como rinite alérgica ou eczema (dermatite atópica). Essas alergias devem ser tratadas de maneira adequada com anti-histamínicos ou corticosteróides de uso local. É possível a ocorrência de broncoespasmo paradoxal. Nesse caso, deve-se descontinuar budesonida e introduzir uma terapia alternativa. Gravidez e lactação — Formoterol: A segurança de formoterol durante a gravidez e a lactação não foi ainda estabelecida. Seu uso durante a gravidez deve ser evitado, a não ser que não exista alternativa mais segura. Como outros estimulantes beta -adrenérgicos, o formoterol pode inibir o trabalho de parto, por seu efeito relaxante na musculatura lisa uterina. Não se sabe se o formoterol passa para o leite materno. O fármaco foi detectado no leite de ratas lactantes. As mães em tratamento com formoterol não devem amamentar. Budesonida: A administração de corticosteróides em animais prenhas resultou em anormalidades no desenvolvimento fetal. A relevância destes achados no homem ainda não está estabelecida. A administração durante a gravidez deve ser evitada; se o tratamento com corticosteróides durante a gravidez for imperativo, corticosteróides inalados devem ser preferidos, pois apresentam menor incidência de efeitos sistêmicos quando comparados com doses equipotentes de corticosteróides orais. Não há informação disponível sobre a passagem de budesonida para o leite materno. Efeitos sobre a habilidade de dirigir veículos e/ou operar máquinas — Não existe nenhum dado que demonstre alteração na habilidade de dirigir veículos e/ou operar máquinas. Interações medicamentosas — Formoterol: Fármacos como quinidina, disopiramida, procainamida, fenotiazínicos, anti-histamínicos e antidepressivos tricíclicos podem ser associados com prolongamento do intervalo QT e com aumento do risco de arritmia ventricular (ver Precauções e advertências). A administração concomitante de outros agentes simpatomiméticos pode potencializar os efeitos não desejados de formoterol. A administração de formoterol a pacientes em tratamento com inibidores da monoaminoxidase ou antidepressivos tricíclicos deve ser conduzida com cautela, já que a ação de estimulantes beta -adrenérgicos no sistema cardiovascular pode ser potencializada. O tratamento concomitante com derivados xantínicos, esteróides ou diuréticos pode potencializar um possível efeito hipocalêmico dos beta -agonistas. A hipopotassemia pode aumentar a suscetibilidade a arritmias cardíacas em pacientes tratados com digitálicos (ver Precauções e advertências). Os bloqueadores beta-adrenérgicos podem diminuir ou antagonizar o efeito de formoterol. Portanto, formoterol não deve ser administrado juntamente com bloqueadores beta-adrenérgicos (inclusive colírios), a não ser que existam razões que obriguem a seu uso. Budesonida: Não foram estabelecidas. Reações adversas — Formoterol: Sistema musculoesquelético: Ocasionais: tremores; raras: mialgias ou cãibras musculares. Sistema cardiovascular: Ocasionais: palpitações; rara: taquicardia. Sistema nervoso central: Ocasional: cefaléia; raros: agitação, vertigem, ansiedade, nervosismo e insônia. Trato respiratório: Raro: agravamento do broncoespasmo. Irritação local: Rara: irritação da orofaringe. Outras: Reações de hipersensibilidade como hipotensão grave, urticária, angioedema, prurido e exantema. Edemas periféricos, alteração do paladar e náuseas. Budesonida: Pode ocorrer uma leve irritação na garganta. Foram relatados casos de candidíase na orofaringe; é recomendado aos pacientes que enxágüem a boca e que escovem seus dentes após cada uso de budesonida. Na maioria dos casos, esta condição responde ao tratamento com antifúngico tópico sem a necessidade de descontinuar budesonida. Rouquidão pode ocorrer; este desconforto é reversível e desaparece após cessar-se a terapia ou redução da dose e/ou descanso vocal. Reações cutâneas como rash (erupção) podem ocorrer, mesmo que raramente. Assim como outras terapias inalatórias, broncoespasmo paradoxal pode ocorrer; acontecendo, o tratamento com budesonida deve ser suspenso e uma terapia alternativa deve ser instituída. Broncoespasmo paradoxal responde a broncodilatadores de rápido início de ação. Foram descritos distúrbios de comportamento em crianças. Posologia e forma de administração — Para uso em adultos e em crianças a partir de cinco anos de idade. Inalação de 1 a 2 cápsulas (12-24 mcg) de formoterol, 2 vezes ao dia, e 1 a 2 cápsulas de budesonida de 200 ou 400 mcg, 2 vezes ao dia. A cápsula de budesonida deve ser inalada pelo menos 1 minuto após a inalação da cápsula de formoterol. Se necessário, 1-2 cápsulas de formoterol, adicionalmente às requeridas para terapia de manutenção, podem ser usadas cada dia para o alívio de sintomas. Se a necessidade de dose adicional for mais do que ocasional (por exemplo, em mais de 2 dias por semana), nova consulta médica deve ser feita e a terapia reavaliada, já que isso pode indicar uma deterioração da condição subjacente. FORASEQ não é recomendado a crianças com menos de 5 anos de idade. Superdosagem — Formoterol: Sintomas: A superdosagem com formoterol provavelmente conduzirá aos efeitos típicos de estimulantes beta -adrenérgicos, a saber: náusea, vômitos, cefaléia, tremores, sonolência, palpitação, taquicardia, arritmia ventricular, acidose metabólica, hipopotassemia e hiperglicemia. Tratamento: São indicados tratamentos sintomático e de suporte. Os casos graves devem ser hospitalizados. Deve ser avaliado o uso de betabloqueador cardiosseletivo, mas apenas sujeito a extremo cuidado, já que o uso de medicação bloqueadora beta-adrenérgica pode provocar broncoespasmo. Budesonida: A toxicidade aguda da budesonida é baixa. O único efeito prejudicial que pode ocorrer após a inalação de uma grande quantidade de medicação em um curto período de tempo é a supressão do eixo hipotalâmico-hipofisário-adrenal (HHA). Não há necessidade de nenhuma ação emergencial. O tratamento com budesonida deve continuar com a dosagem recomendada para o controle da asma. Atenção — Este produto é um novo medicamento e, embora as pesquisas realizadas tenham indicado eficácia e segurança quando corretamente indicado, podem ocorrer reações adversas imprevisíveis ainda não descritas ou conhecidas. Em caso de suspeita de reação adversa, o médico responsável deve ser notificado. Venda Sob Prescrição Médica. Budesonida: Fabricado por Pharmachemie, Holanda. Embalado por Novartis, Inglaterra. Formoterol: Fabricado por Novartis Pharma AG, Suíça. Única concessionária no Brasil de Novartis AG, Suíça; resultante da fusão de Ciba-Geigy e Sandoz. ™ Marca depositada de Novartis AG, Basiléia, Suíça. Serviço de Informações ao Cliente: 0800-8883003. - Registro no M.S. 1.0068.0156. Distribuído por NOVARTIS Biociências S/A. 2 2 2 2 2 2 2