Plan de capacitación en química
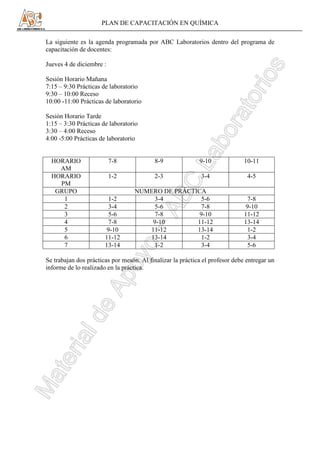
- 1. PLAN DE CAPACITACIÓN EN QUÍMICA La siguiente es la agenda programada por ABC Laboratorios dentro del programa de capacitación de docentes: Jueves 4 de diciembre : Sesión Horario Mañana 7:15 – 9:30 Prácticas de laboratorio 9:30 – 10:00 Receso 10:00 -11:00 Prácticas de laboratorio Sesión Horario Tarde 1:15 – 3:30 Prácticas de laboratorio 3:30 – 4:00 Receso 4:00 -5:00 Prácticas de laboratorio HORARIO 7-8 8-9 9-10 10-11 AM HORARIO 1-2 2-3 3-4 4-5 PM GRUPO NUMERO DE PRÁCTICA 1 1-2 3-4 5-6 7-8 2 3-4 5-6 7-8 9-10 3 5-6 7-8 9-10 11-12 4 7-8 9-10 11-12 13-14 5 9-10 11-12 13-14 1-2 6 11-12 13-14 1-2 3-4 7 13-14 1-2 3-4 5-6 Se trabajan dos prácticas por mesón. Al finalizar la práctica el profesor debe entregar un informe de lo realizado en la práctica.
- 2. PLAN DE CAPACITACIÓN EN QUÍMICA 1. CAMBIOS FÍSICOS Y CAMBIOS QUÍMICOS FUNDAMENTO Se conoce como cambio físico cualquier cambio que se produce sin que varíe la naturaleza de las sustancias, es decir, sin que se formen sustancias nuevas. Por ejemplo, los cambios de estado o las disoluciones. Se conocen como cambios químicos las transformaciones de una, dos o más sustancias en otras diferentes con propiedades características diferentes. Por ejemplo, la oxidación de un metal. En un cambio químico o reacción química unas sustancias se transforman en otras diferentes. Aquellas de las que se parte se denominan reactivos y las sustancias que se forman, productos. Del estudio de muchas reacciones químicas se pueden establecer las siguientes conclusiones: • La existencia de una reacción química se puede poner de manifiesto por un cambio de color, la formación de un sólido, la formación de un gas o un cambio de temperatura. • En las reacciones químicas hay variación de energía. A las reacciones que desprenden energía se les llama exotérmicas. A las que absorben energía, endotérmicas. Un ejemplo de reacción exotérmica es la reacción de combustión. Los combustibles (madera, carbón, gasolina, alcohol, et.) arden en presencia del oxígeno del aire, produciendo dióxido de carbono y agua y liberando energía en forma de calor. • La masa se conserva en las reacciones químicas OBJETIVOS • Diferenciar los cambios físicos de los cambios químicos. • Observar experimentalmente las características de un cambio físico y de un cambio químico. • Desarrollar habilidades para la manipulación del material de laboratorio. INDICADORES INDICADORES DE LOGRO DESARROLLADOS EN LA PRÁCTICA • Formulo preguntas sobre objetos, organismos y fenómenos de mi entorno y exploro posibles respuestas. • Registro mis observaciones en forma organizada y rigurosa (sin alteraciones), utilizando dibujos, palabras y números. • Formulo explicaciones posibles, con base en el conocimiento cotidiano, teorías y modelos científicos, para contestar preguntas. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización es de 60 minutos. MATERIALES Y REACTIVOS • Tubos de ensayo • Acido Clorhídrico • Gradilla • Alcohol • Vaso de precipitados • Soporte Universal • Sulfato de cobre • Mechero de Alcohol • Carbonato de sodio • Pinzas en madera para tubo de ensayo • Limadura de hierro • Pipeta plástica • Cinc en granallas • Lupa • Tubo de ensayo con desprendimiento PROCEDIMIENTO Prepare una solución de sulfato de cobre, para ello mezcle 1 g de sulfato en 10 ml de agua caliente. A continuación tome un tubo de ensayo, y agréguele 4 ml de la solución de sulfato de cobre que ha preparado previamente, posteriormente y usando un gotero o una pipeta pasteur, agregue poco a poco agua, hasta completar 10 ml de muestra, déjelo reposar y vierta 3 ml de alcohol etílico. Observe con la lupa. Ahora, y usando un tubo de ensayo de vidrio, disuelva 0,5 g de Azufre y agréguele 2 gramos de limadura de hierro, trate de mezclarlos con un agitador de vidrio, tome el tubo con las pinzas de madera y caliente. Haga el montaje descrito en la figura, de acuerdo a las siguientes instrucciones: a un tubo de ensayo con desprendimiento, colóquele una manguera y únala al desprendimiento de otro tubo, el cual debe estar lleno de agua, ahora déle la vuelta y sumérjalo en un beaker de 250 ml que también contiene agua, posteriormente deposite dos granallas de cinc en el interior del primer tubo, añádale 5 ml de acido clorhídrico al 37%, (no olvide que esta trabajando con un ácido y que por lo tanto debes manipularlo con mucho cuidado dejándolo no cuidado),
- 3. PLAN DE CAPACITACIÓN EN QUÍMICA resbalar por las paredes del recipiente, tape de inmediato el tubo utilizando un corcho, de acuerdo a lo descrito en la figura y observe lo que sucede. Por último, en un tubo de ensayo prepare 5 ml una disolución de sulfato de manganeso 0,5 mol/L e hidróxido de calcio 2 mol/L. Observe el color inmediatamente después de formado. Agite con precaución la suspensión y déjela expuesta al aire. RESULTADOS Elabore los dibujos correspondientes para cada una de las experiencias realizadas y conteste las siguientes preguntas: • Al observar con la lupa que se puede ver. Que sustancia cree que se formó al interior del tubo de ensayo. Se trata de un cambio químico o físico? Justifique su respuesta. • Al calentar la muestra que sucede con las sustancias químicas que se encuentran en el interior del tubo? Se trata de un cambio físico o químico? Justifique su respuesta. • Al agregar el ácido a la muestra que se encuentra en el tubo de ensayo que sucede con esta? Explique claramente lo que cree que pasó y justifique si se trata de un cambio físico o químico. A qué se debe que el agua que se encuentra en el interior del tubo que esta boca abajo se desplace?¿Cuál es el nombre del gas que se libera? • ¿Que reacción se observa en el tubo de ensayo?. Los componentes mezclados reaccionan o permanecen inertes?. En caso de darse algún tipo de cambio, explique si es físico o químico y el porqué? PREGUNTAS Y EJERCICIOS • ¿Qué diferencia existe entre un cambio físico y un cambio químico?. • ¿De qué forma influye la temperatura sobre los cambios físicos y químicos? • Nombre y describa tres cambios físicos y tres cambios químicos que observe en su entorno. Justifique el porqué los agrupa de esta forma
- 4. PLAN DE CAPACITACIÓN EN QUÍMICA 2. DENSIDAD DE LÍQUIDOS: USO DEL PICNÓMETRO FUNDAMENTO El picnómetro, es un frasco con un cierre sellado, de vidrio con un tapón con un finísimo capilar, de tal manera que un volumen puede obtenerse con gran precisión. Esto permite determinar la densidad de un fluido, tomando como referencia a un fluido de densidad conocida como el agua. Sirve para medir la densidad de líquidos no viscosos. Actualmente, se utilizan picnómetros metálicos para la determinación de la densidad de algunos productos especiales como las pinturas. Este instrumento es sensible a los cambios de concentración de sales en el agua, por lo que se usa para determinar la salinidad del agua, la densidad de líquidos biológicos, entre otras aplicaciones. OBJETIVOS • Determinar la densidad de algunos líquidos. • Identificar algunas propiedades físicas de las sustancias. • Aprender el uso del picnómetro en la medida de la densidad en líquidos. INDICADORES DE LOGRO • Determino la densidad de algunos líquidos. • Identifico la densidad de los sólidos entregados en laboratorio. • Cálculo la medida de la densidad de algunos sólidos usando el picnómetro. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de la práctica es de 80 minutos. MATERIALES Y REACTIVOS • Picnómetro. • 10 ml de agua. • Balanza • 15 g de Cloruro de sodio. • Espátula • 10 ml de alcohol etílico • Un vaso de precipitados de 250 ml • 10 ml de alcohol amílico. • Termómetro. • 10 ml de alcohol metílico. PROCEDIMIENTO PARTE I: MEDIDA DE LA DENSIDAD DEL AGUA Tome el picnómetro de 10 ml y verifique que se encuentre limpio y seco. Posteriormente calibre la balanza ya que se requiere de una óptima medida. Enseguida pese el picnómetro vacío. Ahora llene el picnómetro completamente de agua y enseguida colóquele su tapón, parte del líquido se derramará y por lo tanto deberá secar perfectamente el recipiente y el tapón por fuera. Si queda líquido en las paredes externas provocará error en la medición, a continuación pese el picnómetro lleno de líquido. Quite el tapón al picnómetro y sin vaciarlo vuelva a llenarlo completamente, mida la temperatura a la que se encuentra el agua. Colóquele el tapón, séquelo bien por fuera y vuelva a medir su peso. Repita esta parte tres veces, así obtendrá mediciones que le permitirán obtener tres valores de densidad para el agua. PARTE II: DENSIDAD DE SOLUCIONES SALINAS Lave y seque muy bien el picnómetro de 10 ml. Obtenga diferentes concentraciones de sal en agua para obtener soluciones aproximadas de 0,5 g/100ml., 1 g/100ml., 2 g/100ml., 3 g/100 ml. y 5 g/100ml. Utilice la balanza y la espátula, pese cada una de las cantidades indicadas y disuelvas en 100 ml de agua. No olvide que no se debe pesar directamente sobre el plato de pesada. Determine la densidad de cada concentración utilizando el picnómetro, siguiendo el procedimiento de la parte I de esta práctica pero en este caso no repita la medición, es decir haga solo una medida para cada muestra.
- 5. PLAN DE CAPACITACIÓN EN QUÍMICA PARTE III: DENSIDAD DE LAS SOLUCIONES PROBLEMA Lave y seque muy bien el picnómetro de 10 ml. Repita el procedimiento descrito en la parte I de esta práctica con cada una de las muestras problema solicitadas en este laboratorio, alcohol etílico, alcohol amílico y alcohol metílico, pero en este caso no repita la medición, es decir haga solo una medida para cada muestra. Al pesar cada una de las muestras, no las vote ya que pueden servir para realizar otras prácticas, se supone que si realizo bien la práctica estas muestras no tienen porque contaminarse. RESULTADOS RESULTADOS PARTE I Peso del picnómetro: ___________ Peso del agua = Peso total (picnómetro lleno de agua) – Peso del picnómetro Complete la siguiente tabla de resultados: Medida Peso Total Valor de T° Peso de agua Valor de densidad agua m (g) d= v (ml ) 1 2 3 Valor promedio PARTE II Peso del picnómetro: ___________ Peso de la solución salina = Peso total (picnómetro lleno de solución) – Peso del picnómetro _ ∑ datos Valor promedio = X = número de datos ; Complete la siguiente tabla de resultados: Solución Peso Total Valor de T° Peso de la solución Valor de densidad de la solución 0,005g/ml 0,01g/ml 0,02g/ml 0,03 g/ml 0,05 g/ml Valor promedio PARTE III Complete la siguiente tabla de resultados: Muestra Peso Total Valor de T° Peso de la muestra Valor de densidad de la muestra Alcohol etílico Alcohol amílico Alcohol metílico PREGUNTAS Y EJERCICIOS • ¿Porqué no se puede medir la densidad de líquidos viscosos con el picnómetro? • Consulta cuál es el mejor método para medir la densidad líquidos viscosos. • ¿Cuál es la importancia de medir la densidad de un líquido?. Nombre y explique tres usos del picnómetro a nivel comercial, médico, medio ambiental, etc
- 6. PLAN DE CAPACITACIÓN EN QUÍMICA 3. DETERMINACIÓN DEL PUNTO DE FUSIÓN FUNDAMENTO. El punto de fusión es la temperatura a la cual el estado sólido y el estado líquido de una sustancia, están en equilibrio térmico, a una presión de 1 atmósfera. Por lo tanto, el punto de fusión no es el paso de un estado a otro sino el punto de equilibrio entre el estado sólido y líquido de una sustancia dada. En la mayoría de las sustancias, el punto de fusión y de congelación, son iguales. A diferencia del punto de ebullición, el punto de fusión es relativamente insensible a la presión y, por tanto, pueden ser utilizados para caracterizar compuestos orgánicos y para comprobar la pureza. OBJETIVOS • Determinar experimentalmente el punto de fusión de algunas sustancias orgánicas. • Comprobar la pureza de las sustancias dadas. • Compara los puntos de fusión de las sustancias de la práctica. INDICADORES DE LOGRO • Determino el punto de fusión de una sustancia orgánica. • Compruebo la pureza del compuesto orgánico utilizado. • Comparo los puntos de fusión determinados. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 100 minutos. MATERIALES Y REACTIVOS • Soporte universal. • Alambre de cobre delgado • Pinzas para bureta • Aceite mineral • Termómetro de -10 a 200 0C • Sacarosa (P.F. 170°C) (De fácil consecución) • Mechero de gas Bunsen • Glucosa (P.F. 148°C) • Tubo de Thiele • Acido cítrico (P.F.153°C) • Tubos para punto de fusión • Acido tartárico (P.F. 170º C) • Tapón Horadado • Vidrio de reloj PROCEDIMIENTO Cierre el extremo de un capilar con la ayuda de un mechero, para ello caliente suavemente el extremo de un tubo capilar, girándolo continuamente en la llama del mechero hasta que cierre por completo. Pulverice finamente la muestra (perfectamente seca), en un mortero y colóquela en un vidrio de reloj. Posteriormente introduzca la muestra en el capilar, hasta unos 3 ó 4 mm de altura. Para ello se recoge con el mismo capilar y se presiona con una espátula. Se invierte el tubo y se golpea suavemente el extremo cerrado en una superficie endeble, hasta que el polvo se acumule en la parte baja del capilar. Ahora introduzca el termómetro en un tapón horadado que se ajuste a la boca del Thiele. Sujete el capilar al termómetro (con un caucho, teniendo cuidado de que el sólido del capilar quede a la vista), de modo que el extremo cerrado quede a la altura del bulbo del termómetro. Sujete el tubo de Thiele con una pinza a un soporte, agréguele aceite mineral y caliente gradualmente. El aceite ha de cubrir todo el brazo lateral y el capilar, sin llegar al extremo abierto. A continuación caliente, lentamente, el brazo lateral, para que el calor se propague por convección (transferencia uniforme del calor). Repita el procedimiento para cada una de las sustancias dadas. RESULTADOS Anotar en la tabla los datos obtenidos en el experimento. Calcular el porcentaje de error en la temperatura de fusión experimental por comparación con los valores reales.
- 7. PLAN DE CAPACITACIÓN EN QUÍMICA Temperaturas de fusión Líquido Tfus normal, Tfus, °C Error* (%) °C (laboratorio) 1. Sacarosa 2. Glucosa 3. Acido cítrico 4. Acido tartárico Utilizando los datos obtenidos en la tabla anterior elabore una gráfica comparativa, en el eje “x” escriba los valores correspondientes al número de etiquetado de cada muestra (1. Sacarosa), y en el eje “y” escriba el valor obtenido en cada una de la columnas de la gráfica. T fus (lab) − T fus (real ) % Error = × 100 T fus (real ) PREGUNTAS Y EJERCICIOS • Ponga nombre a cada uno de los elementos señalados en el montaje. • ¿Qué fórmula tiene el ácido benzóico? Dibuje su estructura. • ¿Cuál es su punto de fusión? Compárelo con el valor que ha obtenido. • Consulte, ¿Qué error absoluto y relativo tiene su medida?
- 8. PLAN DE CAPACITACIÓN EN QUÍMICA 4. DESTILACIÓN SIMPLE I. FUNDAMENTO La destilación es el procedimiento más utilizado para la separación y purificación de líquidos, y es el que se utiliza siempre que se va a separar un líquido de sus impurezas no volátiles, como por ejemplo la destilación que se le hace al agua para purificarla. La destilación es la operación de separar, comúnmente mediante calor, los diferentes componentes líquidos de una mezcla, aprovechando las diferencias de volatilidades de los compuestos a separar. La destilación se da en forma natural debajo del punto de ebullición (100 grados centígrados en el caso del agua). La destilación, como proceso, consta de dos fases: en la primera, el líquido pasa a vapor y en la segunda el vapor se condensa, pasando de nuevo a líquido en un recipiente. El equipo utilizado para la destilación en el laboratorio es el llamado destilador o alambique. Éste consta de un balón o matraz con desprendimiento lateral, donde se almacena la mezcla a la que se le aplica calor, un tapón con orificio en donde se coloca un termómetro para ir controlando la temperatura del sistema, un condensador o refrigerante conectado al balón o matraz, un par de mangueras conectadas a la entrada y salida de agua del refrigerante, donde se enfrían los vapores generados, llevándolos de nuevo al estado líquido. Por último, un vaso de precipitado o un erlenmeyer, donde se almacena este líquido concentrado. En la industria química se utiliza la destilación para la separación de mezclas simples o complejas. OBJETIVOS • Identificar los materiales que se emplean en una destilación simple. • Identificar correctamente los procedimientos de una destilación. • Realizar destilación simple de una mezcla de alcohol etílico y agua. INDICADORES DE LOGRO • Reconozco los instrumentos mediante los cuales se realiza una destilación simple. • Identifico paso a paso el procedimiento de una destilación. • Realizo una destilación simple de una mezcla de Alcohol etílico y agua. TIEMPO TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 80 minutos. MATERIALES Y REACTIVOS • 1 Balón para destilación con desprendimiento lateral de 250 ml. • 1 Refrigerante para destilación recto • 1 Tapón de caucho diámetro boca del refrigerante, con orificio • 2 Mangueras de caucho. para el desprendimiento del balón. • 1 Vaso de precipitado de 100 ml. • 1 Pinza metálica tipo araña. • 1 Mechero Bunsen • 1 Pinza con nuez para balón. • 1 Malla de alambre de acero, con ceraflex • 1 nuez doble • 2 Soporte universal • 1 Termómetro de 10 a 200 grados Celsius. • 1 Aro con nuez • 1 Tapón de caucho, diámetro para tapar la boca del balón de • 10 ml de Alcohol etílico destilación con orificio para termómetro. • 20 ml de Agua • 1 Probeta de 100 ml PROCEDIMIENTO Revise muy bien cada una de las piezas del equipo de destilación que se le entrega y reporte cualquier anomalía, antes de utilizarlo. Adicione 30 ml de una mezcla de alcohol etílico- agua (dos partes de agua y una de alcohol) en un balón de destilación y arme el montaje según lo indique el profesor. Antes de iniciar el calentamiento, haga las siguientes comprobaciones: • Que todas las conexiones estén bien ajustadas. • Que la fuente de calentamiento (mechero bunsen) no haga contacto con las mangueras o material volátil. • Que el equipo quede bien ajustado y el fondo del balón haciendo contacto con la malla metálica.
- 9. PLAN DE CAPACITACIÓN EN QUÍMICA • Que el agua esté circulando por el condensador. Abra la llave lentamente y con mucho cuidado ya que la presión en la trompa de vacío es muy alta y puede ocasionar un accidente. Sólo se requiere que esta circule por el condensador sin ninguna presión. Solicite al Docente o al Encargado del laboratorio la aprobación del montaje realizado y continúe con la práctica. PRECAUCIÓN: SI NO HA SIDO AUTORIZADO NO DEBE CONTINUAR YA QUE PUEDE CAUSAR UN ACCIDENTE. Caliente suavemente la mezcla, acerque y retire el mechero convenientemente para realizar un calentamiento controlado y luego anote la temperatura cuando caigan las primeras gotas de destilado (observar la salida del condensador). Continúe destilando y anote la temperatura así: transcurrido un (1) minuto, transcurridos dos (2) minutos y cuando la columna del termómetro se estabilice. Continúe calentando hasta que el goteo del destilado se interrumpa por un tiempo y se presente una variación en la temperatura. Suspenda entonces el calentamiento pero deje circulando el agua durante un tiempo prudencial. ¡PRECAUCIÓN!: NO intente desarmar el montaje estando caliente. Si alguna de las piezas se atora, no trate de forzarla; déjela así y comuníquelo inmediatamente al profesor. VII. RESULTADOS Anote los resultados obtenidos en el cuaderno de laboratorio Grafique o dibuje el montaje utilizado en la destilación. Complete las siguientes tablas de resultados: A las condiciones del laboratorio, punto de ebullición del alcohol 78,5 ºC y el del agua 100 ºC. (En Bogotá 92°C aprox.). 1- TABLA 1- TEMPERATURAS TIEMPO TEMPERATURA Transcurridos 1 minuto Transcurridos 2 minutos Cuando sea estable TABLA 2 - VOLÚMENES SUSTANCIA VOLUMEN EN (ml) Mezcla de Alcohol etílico y agua Destilado Residuo CÁLCULOS Hallar el porcentaje por volumen de alcohol en la mezcla. ECUACIÓN GENERAL % v/v de un componente en una mezcla líquida = volumen del componente X 100/ volumen de la mezcla PREGUNTAS Y EJERCICIOS • ¿Qué son líquidos miscibles y no miscible? • ¿En que dirección debe fluir el agua en el interior del condensador? ¿Porqué? • ¿Qué son las piedras o perlas de ebullición, para qué se utilizan? • ¿En qué consiste la destilación al vacío? • ¿Qué otros tipos de destilación hay?. Nombre y explique dos tipos de destilación.
- 10. PLAN DE CAPACITACIÓN EN QUÍMICA 5. FUNCIONES QUÍMICAS FUNDAMENTO Se conoce como función química a un conjunto de propiedades comunes a una serie de compuestos análogos o semejantes que en el caso de los compuestos inorgánicos los ejemplos más comunes son: hidruros, óxidos metálicos y no metálicos, ácidos que pueden ser hidrácidos y oxácidos, sales neutras, ácidas o básicas, hidróxidos, peróxidos. El grupo funcional se considera como un átomo o grupo de átomos que son los responsables del carácter químico de la molécula a la que pertenecen, en la siguiente tabla se observan las funciones químicas con su respectivo grupo funcional: FUNCIÓN QUÍMICA GRUPO FUNCIONAL Hidruros H-1 Óxidos O-2 Ácidos H+1 Sales Ac- Hidróxidos OH- Peróxidos − O2 1 OBJETIVOS • Determinar la forma en la que se producen los compuestos químicos. • Identificar las principales funciones químicas. INDICADORES DE LOGRO • Determino la forma en la que se producen los compuestos químicos. • Identifico las principales funciones químicas. • Realizo experimentos que conducen al reconocimiento de las principales funciones químicas. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de la práctica es de 110 minutos. MATERIALES Y REACTIVOS • Tubos de ensayo • Sodio. • Espátula • Potasio. • Zinc • Cinta de Magnesio • Vaso de precipitado de 100 ml (Beaker) • Fenolftaleína. • Indicador universal con carta de colores • Acido clorhídrico diluido. • Pinzas para crisol • 2 g de Azufre • Cápsula mediana de porcelana • Tapón de caucho para erlenmeyer • 3 pipetas de 10 ml • Agitador de vidrio. • Pipeteador en caucho con tres válvulas PROCEDIMIENTO PARTE I: PRODUCCIÓN DE UN OXIDO BÁSICO Tome con unas pinzas para crisol 1 cm de cinta de magnesio y acérquela a la llama de un mechero, el magnesio produce una llama fuerte y resplandeciente en el momento en el que hace la ignición, esta es perjudicial para los ojos ya que es demasiado fuerte así que NO MIRE LA LLAMA producida por el magnesio en el momento de la ignición. Deposite el residuo sobrante de la combustión en un beaker o vaso de precipitado de 100 ml. PARTE II: PRODUCCIÓN DE UN OXIDO ÁCIDO Utilizando una espátula, tome dos gramos de azufre y caliéntelos sobre la llama de un mechero. Una vez iniciada la combustión, introduzca la espátula en el erlenmeyer (el cual debe estar en posición invertida) para recoger el gas desprendido, éste es el dióxido de azufre (SO2), un gas muy estable pero que al calentarse fuertemente se disocia en SO2 y S. Evite inhalar el gas. Terminada la combustión, retire la espátula, gire el erlenmeyer y tápelo con un tapón de caucho. PARTE III: PRODUCCIÓN DE UN HIDRÓXIDO PARTE A. Los hidróxidos se pueden producir por reacción directa entre algunos elementos del grupo IA de la tabla periódica y el agua. Tal es el caso del potasio y del sodio, cuando esta reacción se produce se obtiene el hidróxido e hidrógeno, este último, en altas cantidades, reacciona de forma violenta con el oxígeno del aire produciendo una fuerte explosión, por eso es necesario guardar orden en el
- 11. PLAN DE CAPACITACIÓN EN QUÍMICA laboratorio y seguir las instrucciones del docente o del encargado del laboratorio evitando accidentes de los cuales sería responsable la persona que actúa con imprudencia. Aliste una cápsula mediana de porcelana con agua hasta tres cuartas partes de su volumen total, posteriormente y utilizando una espátula tome un pequeño trozo de sodio metálico, tan pequeño como un grano de arroz y deposítelo en la cápsula, guarde la distancia y espere a que todo el sodio se haya disuelto. Agregue 10 gotas de fenolftaleína y observe lo que sucede. Repita el procedimiento, pero en este caso utilice la misma cantidad de potasio. B. La segunda forma en la que se produce un hidróxido es por la reacción de un óxido básico con el agua. Tome el beaker que contiene el residuo obtenido en la parte I de este laboratorio y con la pipeta agréguele 10 ml de agua, agite vigorosamente utilizando el agitador de vidrio hasta obtener una solución lechosa, con una pipeta agregue 10 gotas de fenolftaleína y observe lo ocurrido. (Conserve la pipeta para su uso con la fenolftaleína, no la lave ni la contamine con otro reactivo hasta que se finalice el laboratorio. No vote la solución. PARTE IV: PRODUCCIÓN DE UN ACIDO Los ácidos pueden ser de dos tipos, ácidos hidrácidos o ácidos oxácidos. Los primeros se producen cuando reacciona un elemento del grupo VIIA (bromo, cloro, flúor, yodo) o el azufre con el hidrógeno. Los oxácidos se producen por la reacción de un oxido ácido con el agua. Tome el erlenmeyer que contiene el gas que se desprendió en la combustión del azufre, destápelo con mucho cuidado, evitando que se escape el gas que se encuentra en su interior, vierta en el 100 ml de agua, tápelo nuevamente y agite procurando mezclar el contenido. Destape nuevamente el erlenmeyer, agregue 10 gotas de solución de indicador universal y observe lo ocurrido. No vote la solución. PARTE V: PRODUCCIÓN DE UNA SAL Las sales pueden ser de dos tipos, el primero se conoce con el nombre de hidrosal (sales haloideas o haluros) y se forman cuando reacciona un hidróxido con un hidrácido o un metal directamente con un hidrácido fuerte. El segundo tipo se conoce con el nombre de oxisal y se producen cuando reacciona un oxácido con un hidróxido. Con la espátula tome dos granallas de zinc, deposítelas en un tubo de ensayo y utilizando la pipeta y el Pipeteador de caucho, vierta sobre ellas 5 ml de ácido clorhídrico concentrado (no olvide que este ácido es muy fuerte así que evite el contacto con las manos, piel, boca, ojos o cualquier parte del cuerpo que pueda exponer). Observe lo ocurrido. A continuación mezcle el contenido del beaker con el contenido del erlenmeyer, observe lo que sucede. RESULTADOS RESULTADOS PARTE I Elabore un dibujo con lo realizado en esta parte del laboratorio. Escriba las reacciones químicas incluyendo el tipo de elementos involucrados en la reacción y la función química obtenida. PARTE II Elabore un dibujo con lo realizado en esta parte del laboratorio. Escriba las reacciones químicas incluyendo el tipo de elementos involucrados en la reacción y la función química obtenida. PARTE III Elabore un dibujo con lo realizado en esta parte del laboratorio. Escriba las reacciones químicas incluyendo el tipo de elementos involucrados en la reacción y la función química obtenida. PARTE IV Elabore un dibujo con lo realizado en esta parte del laboratorio. Escriba las reacciones químicas incluyendo el tipo de elementos involucrados en la reacción y la función química obtenida. PREGUNTAS Y EJERCICIOS • ¿Cuál es la importancia de las sales en las actividades humanas? • Cuál cree que es la utilidad de conocer la forma en la que se obtienen los diferentes compuestos químicos inorgánicos • Dónde se forman naturalmente los óxidos, los ácidos, las bases y las sales. De un ejemplo de cada uno.
- 12. PLAN DE CAPACITACIÓN EN QUÍMICA 6. SEPARACIÓN DE MEZCLAS POR EVAPORACIÓN, GRAVIMETRÍA Y DECANTACIÓN FUNDAMENTO Gran parte de la materia que nos rodea está compuesta de mezclas de sustancias. En algunos casos una muestra es una mezcla, mientras que en otros puede ser necesario un examen cuidadoso y usar un instrumental relativamente complejo para determinar si se trata de una sustancia pura o de una mezcla de sustancias. La separación de las sustancias de una mezcla es importante para los procesos químicos en muchas industrias, ya que la mayor parte de los materiales, son mezclas de sustancias. Los procesos de separación simples usados en el laboratorio son los mismos que los de las industrias. Cada uno de ellos tiene una enorme importancia práctica, y son igualmente efectivos a la hora de ser utilizados en un procedimiento químico. Entre los más usuales y sencillos podemos mencionar, la evaporación, la filtración y la decantación. De gran utilidad en las prácticas más comunes en el laboratorio. La evaporación consiste en calentar una mezcla hasta el punto de ebullición de uno de los componentes y dejarlo hervir hasta que se evapore totalmente. Este método se emplea si no se va a utilizar el componente evaporado. Los otros componentes quedan en el envase. La filtración consiste en que uno de los componentes de la mezcla no es soluble en el otro, en ella se encuentra un componente sólido y otro líquido. La mezcla se pasa a través de una placa porosa o un papel de filtro. El sólido, entre tanto, quedará en la placa o en el papel. El otro componente pasará. Se pueden separar sólidos de partículas sumamente pequeñas, utilizando papeles con el tamaño de los poros adecuados. La decantación es un método físico de separación de mezclas especial para separar mezclas heterogéneas, estas pueden ser exclusivamente decantación líquido - líquido ó sólido - líquido. La decantación se basa en la diferencia de densidad física entre los dos componentes de una solución, que hace que dejados en reposo, ambos se separen hasta situarse el más denso en la parte inferior del envase que los contiene. De esta forma, podemos vaciar el contenido por arriba y así separar dichos componentes. OBJETIVOS • Reconocer algunos métodos comunes de separación de mezclas en el laboratorio. • Realizar experimentalmente una evaporación, una filtración y una decantación. • Diferenciar los procedimientos experimentales entre un método y otro de separación de mezclas. LOGRO INDICADORES DE LOGRO • Reconozco métodos de separación de mezclas comunes en el laboratorio. • Desarrollo experimentalmente una evaporación, una filtración y una decantación. • Identifico los diferentes procedimientos experimentales de separación de mezclas. ESTIMADO PRÁCTICA TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 80 minutos. MATERIALES Y REACTIVOS • Papel de filtro • 50 ml de agua • Embudo de decantación • Aro con nuez • Embudo de vidrio • Malla en alambre de acero • Agitador de vidrio • Nuez doble • 2 Vasos de precipitado de 250 ml • Erlenmeyer 250 ml • Mechero • Balanza mecánica triple brazo • Soporte universal • Cloruro de sodio (de fácil consecución) • 50 ml de aceite de cocina • Arena (de fácil adquisición)
- 13. PLAN DE CAPACITACIÓN EN QUÍMICA PROCEDIMIENTO PARTE I: Pese 5g de arena y 5g de cloruro de sodio (sal común, de fácil consecución) y mézclelos. Esta mezcla se vierte en un vaso de precipitado y se le añaden 30 ml de agua, agite y deje reposar unos minutos. A continuación tome un embudo de filtración y colóquele un pedazo de papel de filtro convenientemente doblado (ver figura). Ahora coloque el embudo en la boca de un erlenmeyer. Posteriormente caliente el líquido filtrado para evaporar el agua, hasta que empiecen a aparecer masas o cristales. Observe y anote detalladamente. II: PARTE II: En un beaker de 250 ml, mezcle 50 ml de aceite de cocina con 50 ml de agua. Utilizando el agitador de vidrio agite vigorosamente y deje en reposo durante cinco minutos. Tome un embudo de decantación y verifique que la llave de filtrado se encuentre cerrada, ahora deposite la solución obtenida de acuerdo al montaje de la figura, abra la llave y deje pasar la solución que se encuentra en la parte inferior del embudo (la más cercana a la llave de filtrado), recójala en un beaker de 250 ml y evite que se contamine con la solución que se encuentra en la otra fase. RESULTADOS Anote lo observado en cada punto en su cuaderno de laboratorio y determine qué tipo de separaciones de mezcla se realizaron. Grafique o dibuje. ¿Qué aspecto tiene la sustancia que retiene el papel de filtro en la práctica No 2? ¿Qué sustancia queda en el erlenmeyer? ¿Cómo se llama este proceso de separación? ¿Qué sustancia es retenida en la filtración de la práctica No 2? EJERCICIOS PREGUNTAS Y EJERCICIOS Consulte otros métodos de separación de mezclas y prepare una exposición corta, de dichos métodos.
- 14. PLAN DE CAPACITACIÓN EN QUÍMICA 7. DETERMINACIÓN DE LA FUNCIÓN SAL FUNDAMENTO Una sal es un compuesto neutro producto de la reacción química entre un ácido y un hidróxido. En forma general se pueden clasificar en sales halógenas, las cuales no tienen oxígeno y las oxisales que sí tiene oxígeno en su composición. La reacción química por medio de la cual obtenemos las sales se denomina neutralización y como ya lo hemos mencionado es la reacción entre ácido y base o hidróxido: ácido + hidróxido ———› sal + agua HCl + NaOH ———› NaCl + H2O ácido clorhídrico + hidróxido de sodio ———› cloruro de sodio + agua Existen las oxisales (oxácido + base) y las sales haloideas, éstas últimas se obtienen cuando hidrácido es el que se neutraliza con una base. OBJETIVOS • Determinar experimentalmente la función sal. • Identificar las características más importantes de la función sal. • Observar los distintos cambios que ocurren en la formación de la sal, relacionándolos con otras funciones químicas. INDICADORES DE LOGRO • Determino en el laboratorio la función sal. • Identifico las características más sobresalientes de la función sal. • Explico paso a paso los cambios presentados en cada una de las pruebas realizadas para obtención de la función sal. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 80 minutos. MATERIALES Y REACTIVOS • Mechero • Granallas de zinc • 2 Tubos de ensayo • Acido clorhídrico. • 1 pipeta graduada de 5 ml • Acido Nítrico • 1 vaso de precipitado de 250 ml • Lámina de Cobre o limadura de cobre. • Gradilla • Sodio metálico • Espátula • Fenolftaleína • Trípode • Malla metálica • Pinzas para tubo de ensayo PROCEDIMIENTO PARTE I:: OBTENCIÓN DE UNA SAL HALOIDEA I a. Tome un tubo de ensayo limpio y seco con las pinzas y coloque tres (3) granallas de zinc; por medio de la pipeta agregue lentamente 10 gotas de ácido clorhídrico diluido (5ml de Agua y 0,5 ml de HCl). Ubique el tubo de ensayo en la gradilla y observe. Registre lo observado. II: PARTE II: OBTENCIÓN DE UNA OXISAL a. En el vaso de precipitado, colocar 50 ml de agua y con la ayuda de la espátula corte un trocito de sodio metálico (tan pequeño como un grano de arroz) y colóquelo sobre la superficie del agua; espere unos minutos hasta que se disuelva totalmente. Adicione unas gotas de Fenolftaleína. Observe y tome nota. b. Coja con la pipeta algunos ml de ácido clorhídrico diluido y déjelo caer gota a gota hasta que el color rojo de la solución desaparezca. c. Ponga el vaso de precipitado con la solución en el soporte, y caliéntelo hasta que la solución se halla evaporado totalmente. Deje enfriar y observe las características del sólido obtenido. Observe y note sus conclusiones. d. Tome otro tubo de ensayo y adicione 2, 5 ml de ácido nítrico concentrado utilizando la pipeta totalmente limpia con la bomba de succión. Agregue una lámina pequeña o algunas limaduras de cobre. Ponga el tubo en la gradilla y observe. Tenga la precaución de no aspirar los gases que se desprenden. RESULTADOS
- 15. PLAN DE CAPACITACIÓN EN QUÍMICA Anote lo observado detalladamente en su cuaderno de laboratorio para cada experiencia. Realice con sus compañeros un análisis de lo ocurrido. Escriba las reacciones químicas de esta práctica, sus conclusiones y responda las siguientes preguntas: ¿Cuál es el gas que se desprende en el primer punto de la práctica? ¿Cuál es su importancia y su utilidad? ¿Qué sal se desprendió en este punto? ¿Qué sales se formaron en la segunda parte del procedimiento? PREGUNTAS Y EJERCICIOS Elabore un mapa de conceptos sobre la función sal de acuerdo a la experiencia desarrollada.
- 16. PLAN DE CAPACITACIÓN EN QUÍMICA 8. DETERMINACIÓN DEL pH DE ALGUNAS SUSTANCIAS COMUNES FUNDAMENTO Las sustancias químicas, ya sean de carácter inorgánico u orgánico tendrán un carácter ácido, neutro o alcalino. El pH es un indicador de la acidez de una sustancia. Está determinado por el número de iones libres de hidrógeno (H+) en una sustancia. El pH es una de las propiedades más importantes del agua. El agua disuelve casi todos los iones. El pH sirve como un indicador que compara algunos de los iones más solubles en agua. El resultado de una medición de pH viene determinado por una consideración entre el número de protones (iones H+) y el número de iones hidroxilo (OH-). Cuando el número de protones iguala al número de iones hidroxilo, el agua es neutra. Tendrá entonces un pH alrededor de 7. El pH del agua puede variar entre 0 y 14. Cuando el pH de una sustancia es mayor de 7, es una sustancia básica. Cuando el pH de una sustancia está por debajo de 7, es una sustancia ácida. Cuanto más se aleje el pH por encima o por debajo de 7, más básica o ácida será la solución. El pH es un factor logarítmico; cuando una solución se vuelve diez veces más ácida, el pH disminuirá en una unidad. Cuando una solución se vuelve cien veces más ácida, el pH disminuirá en dos unidades. El término común para referirse al pH es la alcalinidad. OBJETIVOS • Determinar el pH de algunas sustancias comunes en nuestra vida. • Comprender la diferencia que existe entre sustancias acidas y básicas. • Observar la forma en la que actúan los ácidos y las bases sobre otras sustancias. INDICADORES DE LOGRO DESARROLLADOS EN LA PRÁCTICA • Verifico la posibilidad de mezclar diversos líquidos, sólidos y gases. • Formulo explicaciones posibles, con base en el conocimiento cotidiano, teorías y modelos científicos, para contestar preguntas. • Registro mis observaciones en forma organizada y rigurosa (sin alteraciones), utilizando dibujos, palabras y números. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización es de 100 minutos. MATERIALES Y REACTIVOS • Acido clorhídrico. • Pipeteador en caucho de tres válvulas • Acido cítrico. • pH digital. • Bicarbonato de sodio. • Microespátula. • Bisulfato de sodio. • 12 Tubos de ensayo. • Hidróxido de calcio. • Varilla de agitación. • Carbonato de Sodio. • Balanza Mecánica. • Indicador universal solución • Tapón de corcho para tubo de ensayo. • Fenolftaleína. • Cinta de enmascarar blanca. • Naranja de metilo • 6 Pipetas de 10 ml. • Rojo congo. • Acido fórmico PROCEDIMIENTO UNIVERSAL PARTE I : PRUEBA CON EL INDICADOR UNIVERSAL Y LA FENOLFTALEÍNA No olvide que utilizará ácidos en el trabajo que realizará, por lo tanto guarde todas las prevenciones que se le han indicado en las dadas diferentes prácticas de laboratorio ya que las lesiones que cause por no seguir las instrucciones dadas serán su absoluta responsabilidad. Coloque 12 tubos de ensayo en la gradilla, en un tubo de ensayo vierta 1g de acido cítrico y mézclelo con 10 ml de agua destilada, colóquele el tapón y agite hasta obtener una mezcla homogénea, ahora y utilizando una pipeta y un pipeteador, extraiga 5 ml de la solución y viértala en otro tubo de ensayo, usando la cinta de enmascarar, rotúlelas como tubo 1 y 1a. Repita el procedimiento con las muestras de bicarbonato de sodio (2 y 2a), bisulfato de sodio (3 y 3a), carbonato de sodio (4 y 4a), e hidróxido de calcio (5 y 5a). Como el ácido clorhídrico es un líquido, en dos tubos de ensayo vierta 5 ml en cada uno de ellos y rotúlelos como 6 y 6a. A continuación, seleccione una muestra de cada una de las
- 17. PLAN DE CAPACITACIÓN EN QUÍMICA sustancias y agréguele tres gotas de indicador universal, observe lo que sucede. Repita este procedimiento con la segunda muestra pero en lugar de usar el indicador universal utilice la fenolftaleína. PARTE II : PRUEBA CON EL ROJO CONGO Y EL NARANJA DE METILO Coloque 12 tubos de ensayo en la gradilla, en un tubo de ensayo vierta 1g de acido cítrico y mézclelo con 10 ml de agua destilada, colóquele el tapón y agite hasta obtener una mezcla homogénea, ahora y utilizando una pipeta y un pipeteador, extraiga 5 ml de la solución y viértala en otro tubo de ensayo, usando la cinta de enmascarar, rotúlelas como tubo 1 y 1a. Repita el procedimiento con las muestras de bicarbonato de sodio (2 y 2a), bisulfato de sodio (3 y 3a), carbonato de sodio (4 y 4a), e hidróxido de calcio (5 y 5a). Como el ácido clorhídrico es un líquido, en dos tubos de ensayo vierta 5 ml de ácido en cada uno de ellos, utilizando el pipeteador y la pipeta, ahora rotúlelos como 6 y 6a. A continuación, seleccione una muestra de cada una de las sustancias y utilizando la pipeta o un gotero, agregue seis gotas de rojo congo y observe lo que sucede. Repita este procedimiento con la segunda muestra pero en lugar de usar rojo congo utilice la solución de naranja de metilo. PARTE IIII : PRUEBA CON EL pHMETRO DIGITAL II DIGITAL Coloque 9 tubos de ensayo en la gradilla, en un tubo de ensayo vierta 10 ml de jugo de limón, colóquele el tapón y agite hasta obtener una mezcla homogénea, rotúlela como tubo 1. Repita el procedimiento con las muestras de vinagre (2), agua (3) y leche de magnesia (4), ácido fórmico (5) y sustancias sólidas tales como el polvo de hornear (6), tierra (7), carbonato de sodio (8), bicarbonato de sodio (9). Para las muestras sólidas tendrá que mezclar 3g de cada una de ellas con 10 ml de agua destilada. A continuación, seleccione una muestra de cada una de las sustancias, y usando el pHmetro digital mida el pH de cada una de ellas. RESULTADOS PARTE I Utilice la carta de colores que viene con el indicador universal y calcule el pH aproximado de cada una de las muestras de acuerdo al color que tomó. Elabore los dibujos correspondientes a esta parte del laboratorio. Observe el color de la fenolftaleína antes de entrar en contacto con cada una de las muestras, revise el cambio de color de esta al mezclarse con las sustancias dentro de los tubos de ensayo. Al terminar este experimento, llame al profesor para que los materiales utilizados sean desechados correctamente. Complete la siguiente tabla de resultados: Indicador Universal Tubo 1 Tubo 2 Tubo 3 Tubo 4 Tubo 5 Tubo 6 Ph Color Fenol Fenolftaleína Tubo 1 Tubo 2 Tubo 3 Tubo 4 Tubo 5 Tubo 6 Acido/básico/neutro Color PARTE II Observe el color de la solución de rojo congo y del naranja de metilo antes de entrar en contacto con cada una de las muestras, revise el cambio de color al mezclarse con las sustancias dentro de los tubos de ensayo. Al terminar este experimento, llame al profesor para que los materiales utilizados sean desechados correctamente.
- 18. PLAN DE CAPACITACIÓN EN QUÍMICA Solución de rojo congo Tubo 1 Tubo 2 Tubo 3 Tubo 4 Tubo 5 Tubo 6 Acido/básico Color Solución de Naranja de Metilo Tubo 1 Tubo 2 Tubo 3 Tubo 4 Tubo 5 Tubo 6 Acido/básico Color PARTE III Complete la siguiente tabla de resultados: Tubo 1 Tubo 2 Tubo 3 Tubo 4 Tubo 5 Tubo 6 Tubo 7 Tubo 8 Tubo 9 pH PREGUNTAS Y EJERCICIOS • ¿Cuál de los tres métodos utilizados cree que es el más apropiado para identificar el pH de una sustancia? • ¿Porqué cree que es importante conocer el pH de las sustancias que usamos a diario? • ¿De qué otros materiales le gustaría saber el pH?, Propóngale a su profesor una práctica para determinarlos.
- 19. PLAN DE CAPACITACIÓN EN QUÍMICA 9. TITULACIÓN I. FUNDAMENTO La titulación es un método para determinar volumétricamente la concentración de una sustancia determinada en solución, añadiendo una solución normal de volumen y concentración conocidos hasta que la reacción sea completa, indicada usualmente por un cambio de color en un indicador. Una reacción de neutralización entre un ácido y un hidróxido metálico produce agua y una sal. HCl (aq) + Na OH (aq) → H2O (l) + Na Cl (aq) Ecuación iónica neta: H+(aq) + OH-(aq) → H2O(l) Se denomina titulación al procedimiento para determinar la concentración de un ácido o una base en solución, por medio de la adición de una base o un ácido de concentración conocida. Durante la titulación, el punto en que se neutraliza un ácido o una base se denomina punto de equivalencia. Si se va añadiendo poco a poco una base a un ácido, el pH de la solución se incrementa con cada adición de base. El diagrama que representa la variación del pH durante la valoración se denomina curva de titulación. OBJETIVOS • Determinar la concentración de una solución de hidróxido de sodio. • Observar las características de los ácidos y de los hidróxidos. • Observar las reacciones propias de neutralización de ácidos y formación de sales. INDICADORES DE LOGRO • Determino la concentración de una solución de hidróxido de sodio dada. • Realizo una corta exposición sobre las características de los ácidos y los hidróxidos. • Explico el proceso de formación de sales mediante la neutralización acido-base. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 80 minutos. MATERIALES Y REACTIVOS • 2 vasos de precipitados de 250 ml • 1 Erlenmeyer de 250 ml • 1 Agitador de vidrio • 1 Pipeta graduada de 10 ml • 1 Soporte universal • 1 Probeta graduada de 100 ml • 1 Pinzas para bureta (o pinzas universales) • 1 Ácido sulfúrico concentrado • 1 Bureta de 50 ml • 1 Hidróxido de sodio • 2 balones volumétricos de 100 ml • 1 Fenolftaleina • 1 Frasco lavador • 1 Agua destilada PROCEDIMIENTO Prepare una solución 0.1 N de ácido sulfúrico, para ello mida con la probeta 182 ml de agua, colóquelos en un vaso de precipitado, luego mida con la pipeta volumétrica 5 ml de ácido sulfúrico y agréguelos gota a gota al agua medida. Esta será la solución estándar (de normalidad conocida). Ahora, prepare una solución de hidróxido de sodio 0.1 N pesando 0.4g de hidróxido de sodio y mézclelo con agua destilada hasta alcanzar un volumen final de 1000 ml. Tome en un erlenmeyer 10 ml de la solución de ácido sulfúrico que preparó y agréguele 3 gotas de fenolftaleína, agite utilizando para ello el agitador de vidrio. Agregue en la bureta la solución de hidróxido de sodio preparada. Coloque el erlenmeyer con la solución ácida debajo de la bureta, tal y como se muestra en la figura, adicione gota a gota la solución de la bureta a la solución ácida hasta que se observe un cambio en la coloración. Suspenda la adición de la solución de hidróxido de sodio, lea y anote el volumen de base gastado. Repita el procedimiento tres veces y promedie los datos obtenidos. Calcule la normalidad exacta del hidróxido de sodio. V x N = V‘ x N‘ Reserve el resto de solución de hidróxido de sodio de normalidad exacta para la siguiente práctica.
- 20. PLAN DE CAPACITACIÓN EN QUÍMICA RESULTADOS Prueba Número Volumen gastado 1 2 3 PREGUNTAS Y EJERCICIOS • Verifique que los cálculos efectuados para preparar las soluciones sean correctos. • Compare la normalidad hallada por titulación con la indicada en la práctica. ¿Por qué son diferentes y cuál es más exacta? • Compare si el volumen de solución de hidróxido de sodio utilizado es casi igual al volumen de ácido en el erlenmeyer.
- 21. PLAN DE CAPACITACIÓN EN QUÍMICA 10. CURVAS DE TITULACION ACIDO – BASE FUNDAMENTO Si se va añadiendo poco a poco una base a un ácido, el pH de la solución se incrementa con cada adición de base. El diagrama que representa la variación del pH durante la valoración se denomina curva de titulación. Si se representa gráficamente el pH en función de la cantidad de base añadida, se observa una subida brusca en el punto de equivalencia. La región de subida brusca se llama punto final y se reconoce cuando el reactivo indicador cambia de color. El pH de la solución antes del punto de equivalencia se determina por la concentración del ácido que aún no ha sido neutralizado por la base. El pH en el punto de equivalencia es el pH de la sal resultante. Debido a que la sal que se produce por la reacción de un ácido fuerte y una base fuerte no se hidroliza, el punto de equivalencia se produce a pH 7,00. El pH de la solución después del punto de equivalencia está determinado por la concentración del exceso de base en la solución. OBJETIVOS • Observar las características de los ácidos y de los hidróxidos. • Observar las reacciones propias de neutralización de ácidos y formación de sales. • Realizar la curva de titulación de una solución acuosa de ácido sulfúrico 0,1 N con una solución acuosa de hidróxido de sodio 0,1 N INDICADORES DE LOGRO • Realizo un cuadro comparativo entre las características de ácidos y bases observadas en la práctica. • Explico el proceso de neutralización y su importancia en la obtención de sales. • Realizo una curva de titulación de la solución de H2SO4 0.1 N con una solución de NaOH 0,1 N. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 80 minutos. MATERIALES Y REACTIVOS • Erlenmeyer de 250 ml • Agitador de vidrio • Pipeta graduada de 10 ml • Soporte universal • Probeta graduada de 100 ml • Pinzas para bureta (o pinzas universales) • Ácido sulfúrico concentrado al 97% • Bureta de 10 ml • Hidróxido de sodio • 2 balones volumétricos de 100 ml • Fenolftaleina • Frasco lavador • Agua • 3 tiras de papel indicador universal. • 2 vasos de precipitados de 250 ml PROCEDIMIENTO Prepare una solución 0.1 N de ácido sulfúrico, para ello mida con la probeta 182 ml de agua, colóquelos en un vaso de precipitado, luego mida con la pipeta volumétrica 5 ml de ácido sulfúrico y agréguelos gota a gota al agua medida. Esta será la solución estándar (de normalidad conocida). Ahora, prepare una solución de hidróxido de sodio 0.1 N pesando 0.4g de hidróxido de sodio y mézclelo con agua destilada hasta alcanzar un volumen final de 1000 ml. Tome en un erlenmeyer 10 ml de la solución de ácido sulfúrico que preparó y agréguele 3 gotas de fenolftaleína, agite utilizando para ello el agitador de vidrio. Vierta en la bureta, utilizando el embudo, la solución de Na OH(aq) 0.1 N, deje caer solución de la bureta hasta eliminar las burbujas de aire que pudieran estar en el extremo inferior de la misma. Ahora, y usando un matraz Erlenmeyer coloque 10,0 ml de solución H2SO4(aq) 0.1 N, tomado con pipeta aforada. (Si su profesor se lo indica, adicione tres gotas de reactivo indicador, en este caso fenolftaleína). A continuación, coloque sobre placa de vidrio tiras de papel indicador universal. Mida el pH inicial de la solución ácida tocando con una varilla de vidrio (puede usarse el agitador) en el papel indicador, enjuague la varilla y séquela, deje caer 2,0 ml de NaOH, repita el procedimiento para medir el pH. Repita la operación anterior agregando para cada caso los ml base indicados en el cuadro hasta el completar 10,0 ml.
- 22. PLAN DE CAPACITACIÓN EN QUÍMICA RESULTADOS Complete la tabla de datos de acuerdo a lo obtenido durante el experimento. V (ml) de NaOH 0.1 N pH añadidos medido Utilizando la tabla de datos, grafique el pH medido en función de los ml de NaOH agregados. ± 0,1ml 0 2,0 4,0 6,0 8,0 9,0 9,5 10,0
- 23. PLAN DE CAPACITACIÓN EN QUÍMICA 11. ELECTRÓLISIS DEL AGUA I. FUNDAMENTO La electrólisis fue descubierta por el físico químico Michael Faraday en 1820. La electrólisis consiste en la descomposición de algunas sustancias (electrolitos) al someterlas a la corriente eléctrica. El proceso electrolítico consiste en lo siguiente: Se funde o se disuelve el electrolito en un determinado disolvente, con el fin de que dicha sustancia se separe en iones (ionización). Se aplica una corriente eléctrica continua mediante un par de eléctrodos conectados a una fuente de alimentación eléctrica y sumergidos en la disolución. El electrodo conectado al polo negativo se conoce como cátodo, y el conectado al positivo como ánodo. Cada electrodo mantiene atraídos a los iones de carga opuesta. Así, los iones positivos, o cationes, son atraídos al cátodo, mientras que los iones negativos, o aniones, se desplazan hacia el ánodo. La energía necesaria para separar a los iones e incrementar su concentración en los electrodos es aportada por la fuente de alimentación eléctrica. En los electrodos se produce una transferencia de electrones entre estos y los iones, produciéndose nuevas sustancias. Los iones negativos o aniones ceden electrones al ánodo (+) y los iones positivos o cationes toman electrones del cátodo (-). En definitiva lo que ha ocurrido es una reacción de oxidación reducción , donde la fuente de alimentación eléctrica ha sido la encargada de aportar la energía necesaria tras hacer una electrolisis además de desprenderse el oxigeno y el hidrogeno también se dejan ver los otros componentes del agua (minerales, como el hierro entre otros u otros componentes según la zona de donde proviene el agua.); esto en caso de ser agua no destilada, en el agua destilada solo se desprenden el oxigeno y el hidrogeno, porque ya se han extraído los otros componentes previamente. El instrumento que se utiliza hoy en día para la realización de la electrólisis es el voltámetro de Hoffman, el cual consiste en dos eléctrodos inertes de carbono, hierro, platino o níquel (o cualquier material electro - conductor), colocados dentro de las ramas del voltámetro con sus respectivos tapones de caucho en la parte inferior y en contacto con la solución electrolítica. Este voltámetro es fabricado en vidrio de Boro silicato de alta resistencia química, tiene forma de H y consta de dos buretas graduadas con divisiones de 0,5 ml, con desprendimiento lateral inferior y llave de paso superior para recolección de gases, conectados con dos mangueras de látex a los desprendimientos del tubo central. Este cuenta con un embudo esférico superior, por donde se adiciona la solución electrolítica, además el sistema está acoplado con un soporte de madera para mayor estabilidad. Los eléctrodos van conectados a pinzas o caimanes que a su ves lo conectan con una fuente de poder o a una batería de pilas de corriente continua. OBJETIVOS • Reconocer el funcionamiento del voltámetro de Hoffman en la electrólisis del agua. • Comprobar paso a paso como se efectúa la electrólisis del agua. • Reconocer experimentalmente el gas oxígeno y el gas nitrógeno producto de la electrólisis. INDICADORES DE LOGRO • Reconozco el funcionamiento del voltámetro de Hoffman. • Identifico los pasos que se efectúan en la electrólisis del agua. • Reconozco experimentalmente los elementos componentes del agua y sus proporciones. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 100 minutos. MATERIALES Y REACTIVOS • Soporte universal • Gradilla para tubos de ensayo • Pinzas para bureta • Voltámetro de Hoffman • Pinzas para tubo de ensayo • Caimanes para conexión eléctrica • Tapones para tubo de ensayo • Fuente de poder • Pipeta de 10 ml • Palillos de madera (de fácil consecución) • Vaso de precipitado de 500 ml • Acido sulfúrico • Agitador de vidrio • Agua destilada (obtenida en experiencia anterior) • Tubos de ensayo PROCEDIMIENTO 1. Arme el soporte universal enroscando la varilla en la base. Coloque la pinza para bureta y asegure en ella el voltámetro de Hoffman.
- 24. PLAN DE CAPACITACIÓN EN QUÍMICA 2. Tome en un vaso de precipitado 250 ml de agua y adicione por las paredes del vaso en forma lenta, 10 ml de ácido sulfúrico. Agite en forma lenta y continua, durante 2 minutos. 3. Coloque los electrodos en la parte inferior del voltámetro, verificando que los tapones de caucho ajusten con un buen sellado para evitar fugas de líquido. 4. Adicione el agua acidulada en el voltámetro de Hoffman por la parte superior del embudo, hasta llenarlo completamente. Luego cierre las dos llaves de las buretas. 5. Conecte la fuente de poder a la red eléctrica y el voltámetro a la fuente, seleccionando 9 voltios de corriente continua como voltaje de trabajo. Verifique todas las conexiones del circuito eléctrico antes de iniciar la operación de electrólisis. 6. Active el circuito eléctrico moviendo el interruptor de la fuente en posición de prendido, iniciando de esta manera la electrólisis del agua y dando lugar a la formación de hidrógeno gaseoso en el cátodo y de oxígeno gaseoso en el ánodo. 7. Recolecte el gas en un tubo de ensayo colocando la punta de la bureta dentro de la boca de este, el cual debe estar colocado hacia abajo para que el gas quede atrapado dentro y no se salga. Gire la llave de la bureta y permita la salida del gas durante unos segundos y cierre nuevamente. Tape el tubo donde recogió el gas con el tapón de caucho; colóquelo en la gradilla siempre boca abajo. 8. Repita el procedimiento confirmando si el gas es hidrógeno u oxígeno, lo cual se puede establecer porque dentro del voltámetro se baja el nivel del agua en el electrodo del hidrógeno (electrodo negativo) el doble de volumen que en el de oxígeno (electrodo positivo), lo que se puede observar a simple vista. Este experimento se puede repetir todas las veces que sea necesario, para obtener oxígeno y/o hidrógeno. 9. Para comprobar la presencia del oxígeno acerque el ascua de un palillo plano a la boca de uno de los tubos que contiene el oxígeno, retirando por un momento el tapón de caucho de éste. Observe lo que pasa. 10. Con la pinza tome un tubo de ensayo que contenga hidrógeno, colocándolo siempre boca abajo como se indicó en el punto 6, para que el gas contenido no se pierda y acérquelo a otra astilla de madera en ascua, repita el proceso acercando la boca del tubo a la llama del mechero. Observe detenidamente lo que ocurre. VI. RESULTADOS Recoja el agua destilada en un recipiente limpio y utilícela en la preparación de reactivos. Es recomendable guardarla en un frasco de vidrio limpio, seco, con tapa y libre de impurezas para evitar su contaminación. Debe ser utilizada en el menor tiempo posible después de preparada ya que el aire la contamina y por ende pierde gran parte de sus propiedades. Anote paso a paso lo observado en los puntos 5 al 9 de la práctica. Haga un dibujo representativo del montaje y lo sucedido antes y después de realizada la electrólisis. Discuta los resultados obtenidos con el grupo de trabajo y responda las siguientes preguntas: 1. Explique, ¿cómo se comprueba en la experiencia la presencia de hidrógeno y de oxígeno? 2. Explique qué significa que en el Voltímetro de Hoffman la relación de los gases es: el doble de volumen de hidrogeno comparado con el de oxígeno. PREGUNTAS Y EJERCICIOS Consulte la diferencia que existe entre una reacción endotérmica y una exotérmica.
- 25. PLAN DE CAPACITACIÓN EN QUÍMICA 12. ELECTROQUÍMICA: FABRICACIÓN DE PILAS FUNDAMENTO Electroquímica es una rama de la química que estudia la transformación entre la energía eléctrica y la energía química. En otras palabras, las reacciones químicas que se dan en la interfase de un conductor eléctrico (llamado electrodo, que puede ser un metal o un semiconductor) y un conductor iónico (el electrolito) pudiendo ser una disolución y en algunos casos especiales, un sólido. Si una reacción química es conducida mediante un voltaje aplicado externamente, se hace referencia a una electrólisis, en cambio, si el voltaje o caída de potencial eléctrico, es creado como consecuencia de la reacción química , se conoce como un "acumulador de energía eléctrica", también llamado batería o celda galvánica. Las reacciones químicas donde se produce una transferencia de electrones entre moléculas se conocen como reacciones redox, y su importancia en la electroquímica es vital, pues mediante este tipo de reacciones se llevan a cabo los procesos que generan electricidad o en caso contrario, es producido como consecuencia de ella. OBJETIVOS • Aprender a construir pilas electrovoltaicas. • Observar la forma en la que se produce la corriente eléctrica. • Contrastar la teoría de la electrolisis con un experimento práctico. LOGRO INDICADORES DE LOGRO DESARROLLADOS EN LA PRÁCTICA • Identifico las propiedades eléctricas de las sustancias químicas. • Creo pilas electrovoltaicas utilizando sustancias químicas. • Relaciono la información recopilada con los datos de mis experimentos y simulaciones. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 60 minutos. MATERIALES Y REACTIVOS • 2 vasos de precipitado de 100 ml. • Probeta de 100 ml. • 1 vaso de precipitado de 250 ml. • Espátula • Sal de mesa (Cloruro de sodio). • Sulfato de cobre • Lámina de cobre. • Pipeta de 10 ml. • Lámina de zinc. • Agitador en vidrio macizo • Balanza. • 1 LED • Cables de conexión (cable de cobre con filamentos) • Papel filtro. • 1 Multímetro PROCEDIMIENTO PARTE I: CONSTRUCCIÓN DE UNA PILA USANDO CLORURO DE SODIO En el vaso de precipitado de 250 ml prepare una disolución de NaCl (10g de sal en 200 ml de agua del grifo), agite hasta obtener una solución homogénea, ahora vierta 100 ml de la solución en cada uno de los vasos de precipitado de 100 ml, sumerja un cable de cobre unido a la placa de cobre en el primer vaso y en el segundo vaso sumerja un trozo de cinc al que se le ha enlazado otro cable de cobre (en este caso hay que evitar sumergir el cobre en la disolución). Cree un puente electrolítico para asegurar el paso de electrones de una solución a la otra, para ello corte un trozo de papel filtro e imprégnelo con la solución de cloruro de sodio, asegúrese el papel haga contacto con las soluciones que se encuentran en cada vaso. De esta forma se ha montado una pila en la que uno de los electrodos es de cobre y el otro de cinc. Por último conecte el LED a cada uno de los extremos de los cables del circuito, tal y como se indica en el plano: + V1 D1 0V LED1 Las reacciones que tienen lugar en cada uno de los electrodos son: Zn → Zn2+ + 2e- (ánodo→oxidación) 2H + 2e → H2; Cu2+ + 2e- → Cu (cátodo → reducción) + -
- 26. PLAN DE CAPACITACIÓN EN QUÍMICA Conviene destacar que la concentración de H+, resultado de la disociación del agua, y la de Cu2+, que pueda haber en equilibrio con el cobre metal, son muy bajas, por lo que en el cátodo se produce la reducción de ambas especies. Así pues, la intensidad de corriente y el voltaje son bajos porque las concentraciones de las especies que deben reducirse también lo son. PARTE II: CONSTRUCCIÓN DE UNA PILA USANDO SULFATO DE COBRE COBRE En la segunda parte de la práctica vamos a fabricar una pila haciendo uso del sulfato de cobre. Para ello lave muy bien los elementos utilizados en la anterior parte de la práctica, incluyendo la lámina de cobre y la lámina de zinc. Repita el procedimiento descrito en la parte I de esta práctica, pero en uno de los vasos vierta 100 ml cantidad de sulfato de cobre el cual ha preparado disolviendo 5g de sulfato en 100 ml de agua, en el otro vierta 100 ml de solución de Cloruro de sodio (5g de NaCl en 100 ml de agua). No olvide construir el puente electrolítico ya que este será utilizado por los electrones que viajaran desde el ánodo de Zn hacia el cátodo de Cu a través del cable eléctrico, los iones Na+ y Cl- lo hacen por el puente para compensar el movimiento de carga de los electrones. De hecho, la pila no funcionaría sin el puente, pues se crearía un exceso de carga positiva en el ánodo de Zn, por los iones Zn2+ producidos y un exceso de carga negativa en el cátodo de Cu, por la desaparición de iones Cu2+, sendos procesos contribuirían a impedir que nuevos electrones viajasen a través del cable eléctrico desde el electrodo de Zn (ánodo) hasta el electrodo de Cu (cátodo). RESULTADOS PARTE I Elabore los dibujos de la práctica realizada. Si se tiene un multímetro tome el voltaje producido por la pila y escríbalo. De lo contrario y de acuerdo a la intensidad lumínica dada por el LED (generalmente la mayor intensidad se produce a los 5V), dar un valor aproximado del voltaje. PARTE II Elabore los dibujos de la práctica realizada. Si se tiene un multímetro tome el voltaje producido por la pila y escríbalo. De lo contrario y de acuerdo a la intensidad lumínica dada por el LED (generalmente la mayor intensidad se produce a los 5V), dar un valor aproximado del voltaje. De acuerdo a lo anterior, cuál de las dos pilas cree usted que es más eficiente, es decir produce un mayor voltaje. PREGUNTAS Y EJERCICIOS • ¿Porqué se produce el voltaje y la corriente eléctrica? • Consulta acerca de la forma en la que funciona una batería automotriz, elabora los dibujos acerca de su funcionamiento y determina si se trata de una reacción electroquímica.
- 27. PLAN DE CAPACITACIÓN EN QUÍMICA 13. COBRIZADO FUNDAMENTO Al pasar una corriente eléctrica, en condiciones adecuadas, a través de un electrolito en solución se ponen de manifiesto una serie de procesos químicos y físicos que son el objeto de estudio de la electroquímica. Uno de los procesos utilizados y aplicados con mayor frecuencia es el depósito de un metal sobre un electrodo haciendo pasar una corriente eléctrica por la sal que contiene el metal. OBJETIVOS • Identificar la importancia de los procesos electroquímicos en el recubrimiento de metales. • Obtener por medio de la práctica un recubrimiento de cobre metálico sobre otro metal para mejorar sus propiedades. • Identificar el cobrizado como un proceso electroquímico. INDICADORES DE LOGRO • Identifico la importancia de los procesos electroquímicos en el recubrimiento de metales. • Obtengo mediante un proceso práctico un recubrimiento electroquímico de cobre. • Identifico el cobrizado como un ejemplo de proceso electroquímico. PRÁCTICA TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de la práctica es de 100 minutos. MATERIALES Y REACTIVOS Cuba electrolítica Pieza metálica para recubrir de cobre ( tornillo, Fuente de poder arandela, tuerca, etc.) Cables de conexión Hidróxido de sodio, solución al 10%. 4 vasos de precipitado Ácido clorhídrico, solución al 10% 2 electrodos de cobre Ácido sulfúrico (2ml) Balanza Agua Pinza Sulfato de cobre Papel de filtro o gasa. Cobre metálico en alambre o láminas Jabón en polvo PROCEDIMIENTO Para que el cobre se deposite sobre la pieza metálica se debe realizar una limpieza profunda, proceso que industrialmente recibe el nombre de decapado: 1. Prepare una solución jabonosa y sumerja la pieza metálica con las pinzas, procurando no tomar la pieza en ningún paso con los dedos. Remueva la grasa y la mugre de la pinza con un cepillo dental o con algún elemento, de tal forma que el líquido penetre en todos los lugares de la pieza. Enjuague en agua destilada, después que confirme que toda la mugre fue removida. 2. Sumerja la pieza metálica en la solución de hidróxido de sodio al 10%, con la pinza agitándola suavemente. Asegúrese que la pieza metálica reciba en todas partes la solución alcalina incluyendo los sitios más difíciles; después de lavar detenidamente la pieza, sacuda y haga un enjuague con agua destilada para retirar los residuos alcalinos. 3. Tome la pieza con las pinzas y pásela al baño de ácido clorhídrico al 10% remojándola por todas partes durante dos minutos aproximadamente. La solución ácida neutraliza el residual que haya podido quedar de la solución de hidróxido de sodio. Enjuague la pieza con agua destilada y séquela completamente sin cogerla con los dedos, utilizando las pinzas en forma permanente, pésela en la balanza con la mayor exactitud. 4. Prepare la solución de sulfato de cobre, agregando en un vaso de precipitado 250 gramos de sulfato y un litro de agua desmineralizada. Colóquelo sobre el agitador eléctrico y dé inicio a la agitación hasta que el soluto quede completamente disuelto. Agregue10 ml de ácido sulfúrico por las paredes del vaso y agite nuevamente hasta tener una muestra homogénea, filtre la solución pasándola por un papel de filtro para retener las impurezas insolubles. Finalmente pase la solución a la cuba electrolítica y conecte los cables de conexión a la fuente de poder, seleccionando un voltaje de salida en corriente continua de 9 voltios. 5. Tome la lámina o el alambre de cobre y péselo con exactitud en la balanza. Haga el montaje en la cuba electrolítica colocando en el polo positivo o ánodo, la lámina o el alambre de cobre recientemente pesado y en el cátodo o polo negativo la pieza que se
- 28. PLAN DE CAPACITACIÓN EN QUÍMICA quiere recubrir de cobre. Conecte los cables de conexión de la fuente a los electrodos o polos identificando el positivo y el negativo. Verifique que la pieza que se quiere recubrir y el alambre o la lámina de cobre se encuentren sumergidos en la solución. 6. Una vez que todo el montaje esté listo y revisado, seleccione un voltaje de salida entre 6 y 12 voltios de corriente continua, prenda el interruptor y tome el tiempo de inicio con un reloj o un cronómetro. Verifique que la reacción de electrodeposición se está efectuando si observa que en el ánodo se forma un burbujeo. Después de transcurridos 5 minutos exactos de la electrodeposición, suspenda el proceso apagando el interruptor, luego saque la pieza recubierta de cobre, séquela y pésela nuevamente con exactitud. 7. Una vez al comparar los pesos notará que la pieza recubierta de cobre (cobrizada) aumentó el peso mientras que el alambre de cobre o la lámina disminuyó. 8. Guarde la solución que se encuentra en la cuba para posteriores trabajos y la fuente de poder límpiela y guárdela, lo mismo que la cuba de electrodeposición. RESULTADOS Anote las observaciones y resultados de cada uno de los pasos de la práctica en el cuaderno de laboratorio. Escriba el análisis y conclusiones del grupo. Realice un diagrama de flujo de los pasos que se dieron en esta práctica. EJERCICI PREGUNTAS Y EJERCICIOS Según lo observado en la práctica explique con argumentos, qué es un cobrizado y para qué se aplica en la industria. Investigue los conceptos de: equivalente químico, culombio, intensidad de corriente y leyes de Faraday.
- 29. PLAN DE CAPACITACIÓN EN QUÍMICA 14. CONDUCTIVIDAD FUNDAMENTO La conductividad eléctrica es la capacidad de un cuerpo de permitir el paso de la corriente eléctrica a través de sí. También es definida como la propiedad natural característica de cada cuerpo que representa la facilidad con la que los electrones (y huecos en el caso de los semiconductores) pueden pasar por él. Varía con la temperatura. Es una de las características más importantes de los materiales. Aparentemente las soluciones ionizadas tienen mayor capacidad de conducción de electrones que los materiales sólidos debido a la baja resistencia que ofrecen al paso de los electrones. OBJETIVOS • Comprender experimentalmente el comportamiento de un electrolito. • Verificar el carácter electrolítico de una sustancia. • Comprender los principios de la conducción eléctrica. INDICADORES DE LOGRO DESARROLLADOS EN LA PRÁCTICA • Verifico la conducción de electricidad o calor en materiales. • Identifico las funciones de los componentes de un circuito eléctrico. TIEMPO ESTIMADO PARA LA PRÁCTICA El tiempo estimado para la realización de esta práctica es de 80 minutos. MATERIALES Y REACTIVOS • Cuba electrolítica • Portalámparas con bombillo • 2 electrodos metálicos • Agua destilada • 2 porta electrodos • Cloruro de sodio • Fuente de poder • Acido nítrico • 2 cables de conexión • Vaso de precipitado de 600 ml • Agitador en vidrio PROCEDIMIENTO Coloque en la cuba electrolítica los dos electrodos metálicos, cada uno con su respectivo portaelectrodo y separados al máximo. Conecte los cables desde los electrodos pasando por el bombillo hasta la fuente de poder. Conecte la fuente de poder a la red eléctrica. Seleccione un voltaje de salida de acuerdo al bombillo utilizado en la práctica. Conecte la roseta con el bombillo de tal forma que el circuito quede en serie. Agregue en la cuba agua destilada hasta completar el 70% del volumen total. Prenda el interruptor de la fuente y confirme si el agua destilada es conductora o no de la corriente. Desconecte la corriente eléctrica o apague el interruptor de la fuente de poder. Ahora, utilizando el agitador de vidrio, mezcle en el vaso de precipitado 100 ml agua destilada y 20 gramos de cloruro de sodio, agite vigorosamente hasta que se disuelva completamente la sal. Adicione esta solución salina a la cuba electrolítica y repita el procedimiento pulsando el interruptor y verificando si prende el bombillo para confirmar o negar la conductividad de una solución salina. Repita el experimento cambiando la sal por 10 ml de ácido nítrico, luego por 20 g de azúcar, luego por 10 ml de jugo de limón y establezca cuáles son los electrolitos y cuáles no. RESULTADOS Dibuje lo observado en cada una de las partes de la práctica. Según lo que ha observado en la práctica y utilizando sus propias palabras defina: Electrolito Conductividad Resuelva las siguientes preguntas: ¿Qué sucede al aumentar o diminuir la cantidad de sal en la solución? Explique si el agua destilada es o no conductora, justifique su explicación.
- 30. PLAN DE CAPACITACIÓN EN QUÍMICA ¿Qué se debe hacer para aumentar o disminuir la intensidad de la luz en la práctica? PREGUNTAS Y EJERCICIOS • Elabore un cuadro comparativo entre los materiales sólidos conductores y las sustancias líquidas conductoras, establezca 3 ventajas y 3 desventajas de cada una de ellas. • Consulta el porqué las partes eléctricas o electrónicas de algunos componentes necesitan refrigeración. • Consulta acerca de las principales aplicaciones de las sustancias conductoras y explique cada una de ellas.