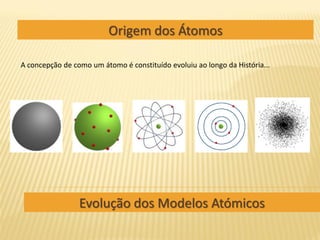
Evolução dos Modelos Atómicos
- 1. Origem dos Átomos A concepção de como um átomo é constituído evoluiu ao longo da História... Evolução dos Modelos Atómicos
- 2. “Primeiro” modelo do Átomo Demócrito, Demócrito e Leucipo, filósofos gregos do século V a. C., século V a.C. sugeriram que toda a matéria era constituída por partículas de pequeníssimas dimensões indivisíveis que designaram por átomos. Como esta ideia não tinha um suporte experimental, não pode ser considerada uma teoria cientifica, tendo sido abandonada durante muitos séculos. Esfera que Dalton utilizou para No inicio do século XIX, esta ideia ressurgiu, graças aos demonstrar as suas teorias sobre o átomo. trabalhos experimentais de químicos como Lavoisier, Boyle e Proust. Um físico e químico inglês, John Dalton, considerava o átomo como sendo uma esfera indivisível e indestrutível, que se mantinha inalterada durante uma transformação química, possuindo cada elemento químico um “peso” característico.
- 3. Modelo do pudim de passas O físico inglês, Joseph Thomson, efectuou experiências com tubos de descarga, descobrindo a existência de particulas subatómicas de carga eléctrica negativa – os electrões. Esta descoberta conduziu à proposta, em 1909, de um novo modelo atómico, em que o átomo seria uma massa esférica maciça, de carga eléctrica positiva uniformemente distribuída, em que os electrões (corpúsculos de carga eléctrica negativa) se encontravam dispersos. Os electrões existiriam em número suficiente para que a carga global do átomo fosse nula. Um paralelismo com o pudim de passas justifica a designação atribuída – Modelo do Pudim de Passas. Modelo atómico de Thomson Modelo do Pudim de Passas
- 4. Modelo Planetário Ernest Rutherford, baseando-se nos resultados obtidos durante a realização de uma experiência em que bombardeou uma finíssima lâmina de ouro com partículas α (núcleos de átomos de hélio), propôs um novo e completamente diferente modelo atómico. Segundo Rutherford, o átomo seria constituído por um núcleo muito pequeno, quando comparado com o tamanho do átomo, de carga positiva. O núcleo apresenta, no entanto, a quase totalidade da massa do átomo dai grande parte do átomo ser espaço vazio. Os electrões, possuindo carga eléctrica negativa, mover-se-iam a grande velocidade em torno do núcleo, tal como os planetas do Sistema Solar se Modelo atómico de Rutherford Modelo Planetário movem em torno do Sol – Modelo Planetário.
- 5. Modelo dos Estados Estacionários Niels Bohr propôs, em 1913, algumas alterações ao modelo de Rutherford, sugerindo um novo modelo – Modelo dos Estados Estacionários. Segundo o modelo atómico de Bohr: os electrões movem-se em torno do núcleo, descrevendo orbitas circulares; a cada orbita está associado um determinado valor de energia, ou seja a energia está quantificada; enquanto um electrão se movimenta numa determinada orbita, não absorve (ganha) nem emite (perde) energia; os electrões com menor valor de energia movem-se em orbitas mais próximas do núcleo atómico e os Modelo atómico de Bohr electrões com maior valor de energia movem-se em Modelo dos Estados Estacionários orbitas mais afastadas do núcleo atómico.
- 6. Modelo dos Estados Estacionários (Cont.) Apesar de explicar os resultados experimentais obtidos para o átomo de hidrogénio, o modelo de Bohr não conseguia explicar os resultados obtidos para os restantes elementos químicos.
- 7. Modelo da Nuvem Electrónica A partir de 1920, cientistas como De Broglie, Schrödinger, Heisenberg e Dirac desenvolveram a Teoria Atómica Contemporânea, originando o modelo atómico actualmente aceite pela comunidade cientifica – Modelo Quântico ou Modelo da Nuvem electrónica. Segundo as leis da Mecânica Quântica, os electrões movem-se com elevada velocidade, sendo impossível saber exactamente, num determinado instante, a posição e o momento linear de um electrão relativamente ao núcleo. Assim, não se pode associar a um electrão uma trajectória; apenas se pode saber que a probabilidade de Congresso de Física Quântica em 1927 encontrar um electrão num determinado local do espaço atómico é maior do que noutros.
- 8. Modelo da Nuvem Electrónica (Cont.) Abandonou-se o conceito de orbita bem definida, dando lugar a orbital – região do espaço atómico onde há maior probabilidade de encontrar o electrão. Modelo da Nuvem Electrónica A nuvem electrónica é mais densa perto do núcleo atómico, onde a probabilidade de encontrar o electrão é maior, e menos densa longe do núcleo, onde a probabilidade de encontrar o electrão é menor.